Trans-cyklookten
| trans-Cyklookten | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | (E)-cyklookten |
| Sumární vzorec | C8H14 |
| Identifikace | |
| Registrační číslo CAS | 931-89-5 |
| EC-no (EINECS/ELINCS/NLP) | 213-245-5 |
| PubChem | 5463599 |
| ChEBI | 73156 |
| SMILES | C1CCC/C=C/CC1 |
| InChI | InChI=1S/C8H14/c1-2-4-6-8-7-5-3-1/h1-2H,3-8H2/b2-1+ |
| Vlastnosti | |
| Molární hmotnost | 110,20 g/mol |
| Teplota tání | −59 °C (214 K) |
| Teplota varu | 143 °C (416 K) |
| Hustota | 0,848 g/cm3 |
Některá data mohou pocházet z datové položky. | |
trans-Cyklookten je organická sloučenina se vzorcem [–(CH2)6CH=CH–], patřící mezi cykloalkeny.
Cyklookten je nejnižším cykloalkenem, u kterého lze snadno izolovat jeho trans-izomer. Cis-izomer je mnohem stabilnější;[1] energie kruhového napětí činí u trans-cyklooktenu 70 a u cis-izomeru 31 kJ/mol.[2]
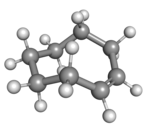 | 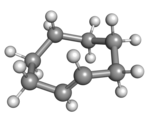 |
| cis v židličkové konformaci | (Rp)-trans-cyklookten v korunové konformaci |
Rovinné uspořádání uhlíkového řetězce by mělo příliš vysoké kruhové napětí a stabilní konformací trans-formy je tak ohnutý (tedy nerovinný) kruh. Výpočty naznačují, že nejstálejší je „korunová“ konformace, která má atomy uhlíku střídavě nad a pod rovinou kruhu.[3] Položidličková konformace, s energií asi o 24 kJ/mol vyšší, má uhlíky 2,3,5,6, a 8 na jedné a uhlíky 1,4, a 7 na druhé straně.[3]
Všechny konformace trans-cyklooktenu jsou chirální[4] a jednotlivé enantiomery od sebe lze oddělit.[5][6][7]
Jeden enantiomer lze teoreticky přeměnit na druhý bez štěpení vazeb, otočením celé skupiny –CH=CH– o 180°; jeden z vodíků by se ale musel posunou přes kruh.[5]
Příprava
trans-Cyklookten poprvé připravil Arthur C. Cope Hofmannovou eliminací z jodidu N,N,N-trimethylcyklooktylamonného.[8] Reakcí vznikala směs cis a trans-izomeru, trans-izomer byl zachycen jako komplex s dusičnanem stříbrným.
trans-Cyklookten lze oddělit od cis-izomeru i jinými způsoby, například (s téměř 100% výtěžkem) přeměnou cis-izomeru na 1,2-epoxycyklooktan a následnými reakcemi s difenylfosfidem lithným a jodmethanem; podobně lze získat i oba izomery cyklookta-1,4-dienu a cyklookta-1,5-dienu.[9]
Je také známa přímá fotochemická cis–trans izomerizace. Rovnováha je výrazně posunuta k cis'-cyklooktenu, ale lze ji posunout k trans-produktu zachycováním stříbrnými ionty.[10][11]
Reakce
Dvojná vazba vytváří vyšší kruhové napětí, než kdyby stejně velký kruh obsahoval pouze jednoduché vazby; trans-izomer je reaktivnější než cis-izomer, například se na jeho dvojnou vazbu snadno adují tetraziny[3] a za přítomnosti rutheniových iniciátorů se tato sloučenina polymerizuje.[2]
Reference
V tomto článku byl použit překlad textu z článku trans-Cyclooctene na anglické Wikipedii.
- ↑ Ulrich Neuenschwander; Ive Hermans. The conformations of cyclooctene: Consequences for epoxidation chemistry. Journal of Organic Chemistry. 2011, s. 10236–10240. DOI 10.1021/jo202176j. PMID 22077196.
- ↑ a b Ron Walker; Rosemary M. Conrad. The Living ROMP of trans-Cyclooctene. Macromolecules. 2009, s. 599–605. DOI 10.1021/ma801693q. PMID 20379393. Bibcode 2009MaMol..42..599W.
- ↑ a b c Ramajeyam Selvaraj; Joseph M. Fox. trans-Cyclooctene — A stable, voracious dienophile for bioorthogonal labeling. Current Opinion in Chemical Biology. 2013, s. 753–760. DOI 10.1016/j.cbpa.2013.07.031. PMID 23978373.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.p04681. (anglicky) DOI: 10.1351/goldbook.
- ↑ a b Arthur C. Cope; C. R. Ganellin; H. W. Johnson; T. V. Van Auken; Hans J. S. Winkler. Molecular Asymmetry of Olefins. I. Resolution of trans-Cyclooctene1-3. Journal of the American Chemical Society. 1963, s. 3276–3279. DOI 10.1021/ja00903a049.
- ↑ Arthur C. Cope; Anil S. Mehta. Molecular Asymmetry of Olefins. II. The Absolute Configuration of trans-Cyclooctene. Journal of the American Chemical Society. 1964, s. 5626–5630. DOI 10.1021/ja01078a044.
- ↑ Steven D. Paget. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: John Wiley & Sons, 2001. ISBN 0471936235. DOI 10.1002/047084289X.rd119. Kapitola (−)-Dichloro(ethylene)(α-methylbenzylamine)platinum(II).
- ↑ COPE, Arthur C.; BACH, Robert D. trans-Cyclooctene. Org. Synth.. 1969, s. 39. Dostupné online.; Coll. Vol.. S. 315.
- ↑ Edwin Vedejs; Karel A. J. Snoble; Philip L. Fuchs. Phosphorus betaines derived from cycloheptene and cyclooctene oxides. Inversion of cyclooctene. Journal of Organic Chemistry. 1973. DOI 10.1021/jo00946a024.
- ↑ John S. Swenton. Photoisomerization of cis-cyclooctene to trans-cyclooctene. Journal of Organic Chemistry. 1969, s. 3217–3218. DOI 10.1021/jo01262a102.
- ↑ Maksim Royzen; Glenn P. A. Yap; Joseph M. Fox. A photochemical synthesis of functionalized trans-cyclooctenes driven by metal complexation. Journal of the American Chemical Society. 2008, s. 3760–3761. DOI 10.1021/ja8001919. PMID 18321114.
Média použitá na této stránce
Autor: Charlesy, Licence: CC0
Ball and Stick model of (Rp)-trans-cyclooctene in crown conformation.
Autor: Smokefoot, Licence: CC BY-SA 4.0
chemical structure of trans-cyclooctene
Autor: Charlesy, Licence: CC0
Ball-and-stick model of cis-cyclooctene in chair conformation.


