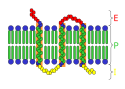
Transmembránový receptor
Transmembránový receptor, nebo také buněčný povrchový receptor nebo membránový receptor je receptor v membránách buněk umožňující buněčnou signalizaci tím, že se něj naváže extracelulární molekula (ligand) a způsobí tím nějakou změnu uvnitř buňky. Mezi extracelulární molekuly patří mohou být hormony, neurotransmitery, cytokiny, růstové faktory, buněčné adhezní molekuly, nebo živiny. Reakce s transmembránovým receptorem vyvolá změny v metabolismu a činnosti buněk.
Struktura a mechanismus
Mnoho transmembránových receptorů jsou transmembránové proteiny, např. glykoproteiny a lipoproteiny.[1] Stovky různých receptorů jsou známy a mnoho dalších je doposud nepopsaných.[2][3] Transmembránové receptory jsou obvykle klasifikovány na základě jejich terciární (trojrozměrné) struktury., příp. mohou být klasifikovány na základě membránové topologie. Strukturálně nejjednodušší receptory protínájí polypeptidovým řetězcem lipidovou dvojvrstvu jednou, zatímco jiné, jako je receptory spřažené s G proteinem sedmkrát. Každá buněčná membrána může mít několik druhů membránových receptorů, s různou jejich povrchovou distribucí, navíc mohou být v různých pozicích v membráně v závislosti na druhu membrány a buněčné funkci. Receptory jsou převážně sdruženy na povrchu membrány.[4][5]
Mechanismus
Vysvětlení mechanismu účinku je dvojí:
- Dimerizace: tento model naznačuje, že před vazbou na ligand, receptory existují v monomerní formě. Když se naváže agonista , monomery se spojují a vytvářejí aktivní dimer.
- Rotace: vazba ligandu na extracelulární část receptoru vyvolává rotaci (konformační změnu) částí transmembránového helixu receptoru. Rotace se mění, pokud části receptorů jsou vystaveny na intracelulární straně membrány, mění to, jak receptor může interagovat s jinými proteiny v buňce.[6]
Domény

P = plazmatická membrána
I = intracelulární prostor
Jako každá integrální membránové proteiny, transmembránové receptory mohou být rozděleny do tří domén.
Extracelulární doména
Extracelulární doména jen externě z buňky nebo organely. Pokud polypeptidový řetězec prochází přes dvojvrstvu několikrát, externí domény se skládá ze smyček propletených skrze membránu. Její hlavní funkcí je rozpoznat a reagovat na ligand, např. neurotransmiter, hormon, nebo atomární ionty.
Transmembránové doména
Ve většině rozpoznaných receptorů transmembránová alfa šroubovice tvoří většinu transmembránové komponenty, např. nikotinový receptor acetylcholinu transmembránová doména je tvořena proteinovým pórem skrze membránu obtékající iontový kanál. Při aktivaci extracelulární domény vazbou vhodného ligandu, se pór stává přístupný pro některé ionty, které mohou difundovat skrze membránu. U jiných receptorů dochází po navázání ligandu ke konformační změně, která ovlivňuje intracelulární podmínky.
Intracelulární doména
Intracelulární (nebo cytoplazmatická) doména receptoru působí na vnitřek buňky nebo organely, a tím přenáší vnější ignál. Existují dvě základní cesty :
- Intracelulární doména komunikuje prostřednictvím protein-protein interakce na efektorové proteiny, které předají signál do místa určení.
- U enzymatických receptorů intracelulární domény mají enzymatickou aktivitu, např. tyrosin kinázovy, často napojené na intracelulární domény.
Další příklady
- Adrenergní receptor,
- Čichové receptory,
- Receptor tyrosin kinázy
- Receptor pro epidermální růstový faktor
- Inzulínový Receptor
- Fibroblastový růstový faktor receptory,
- Vysokou afinitu neurotrophin receptory
- Ephrin receptory
- Integrins
- Nízkou Afinitu Nervový Růstový Faktor Receptor
- NMDA receptor
- Několik Imunitní receptory
- Toll-like receptor
- T buněčný receptor
- CD28
- Protein SCIMP
Související články
- Druhý posel
- Neuromodulátor
Externí odkazy
 Obrázky, zvuky či videa k tématu transmembránový receptor na Wikimedia Commons
Obrázky, zvuky či videa k tématu transmembránový receptor na Wikimedia Commons
Reference
- ↑ Cuatrecasas P. MEMBRANE RECEPTORS. Annual Review of Biochemistry. 1974, s. 169–214. DOI 10.1146/annurev.bi.43.070174.001125. PMID 4368906. (anglicky)
- ↑ Dautzenberg FM, Hauger RL. The CRF peptide family and their receptors: yet more partners discovered. Trends Pharmacol. Sci.. February 2002, s. 71–7. Dostupné online. DOI 10.1016/S0165-6147(02)01946-6. PMID 11830263. (anglicky)
- ↑ Rivière S, Challet L, Fluegge D, Spehr M, Rodriguez I. Formyl peptide receptor-like proteins are a novel family of vomeronasal chemosensors. Nature. May 2009, s. 574–7. DOI 10.1038/nature08029. PMID 19387439. (anglicky)
- ↑ Rothberg K.G.; YING Y.S.; KAMEN B.A.; ANDERSON R.G. Cholesterol controls the clustering of the glycophospholipid-anchored membrane receptor for 5-methyltetrahydrofolate. The Journal of Cell Biology. 1990, s. 2931–2938. DOI 10.1083/jcb.111.6.2931. PMID 2148564. (anglicky)
- ↑ Jacobson C.; CÔTÉ P.D.; ROSSI S.G.; ROTUNDO R.L.; CARBONETTO S. The Dystroglycan Complex Is Necessary for Stabilization of Acetylcholine Receptor Clusters at Neuromuscular Junctions and Formation of the Synaptic Basement Membrane. The Journal of Cell Biology. 2001, s. 435–450. DOI 10.1083/jcb.152.3.435. PMID 11157973. (anglicky)
- ↑ MARUYAMA, Ichiro N. Activation of transmembrane cell-surface receptors via a common mechanism? The "rotation model". BioEssays. 2015-09-01, s. 959–967. Dostupné online. ISSN 1521-1878. DOI 10.1002/bies.201500041. PMID 26241732. (anglicky)
Média použitá na této stránce
Autor: Mouagip, Licence: CC BY-SA 3.0
A schematic of a transmembrane receptor