Trichlortriazin
| Trichlortriazin | |
|---|---|
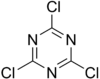 Strukturní vzorec trichlortriazinu | |
 Model molekuly trichlortriazinu | |
| Obecné | |
| Systematický název | 2,4,6-trichlor-1,3,5-triazin |
| Ostatní názvy | kyanurylchlorid, trichlorkyan, kyanurchlorid, cyanurchlorid |
| Anglický název | Cyanuric chloride |
| Německý název | Cyanurchlorid |
| Sumární vzorec | C3Cl3N3 |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 108-77-0 |
| EC-no (EINECS/ELINCS/NLP) | 203-614-9 |
| PubChem | 7954 |
| SMILES | Clc1nc(Cl)nc(Cl)n1 |
| Číslo RTECS | XZ1400000 |
| Vlastnosti | |
| Molární hmotnost | 184,41 g/mol |
| Teplota tání | 154 °C |
| Teplota varu | 192 °C |
| Hustota | 1,32 6 g/cm3 |
| Rozpustnost ve vodě | hydrolyzuje |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Trichlortriazin (též kyanurylchlorid, trichlorkyan, kyanurchlorid či cyanurchlorid; systematický název 2,4,6-trichlor-1,3,5-triazin) je anorganická sloučenina se vzorcem (NCCl)3. Tato bezbarvá tuhá látka je chlorovaným derivátem 1,3,5-triazinu. Jedná se o trimer chlorkyanu.[2] Je hlavním prekurzorem populárního, avšak kontroverzního herbicidu atrazinu.
Výroba
Trichlortriazin se vyrábí ve dvou krocích z kyanovodíku přes meziprodukt chlorkyan, který se trimerizuje za zvýšené teploty na uhlíkovém katalyzátoru:
- HCN + Cl2 → ClCN + HCl
- 3 ClCN → (ClCN)3
V roce 2005 se na světě vyrobilo zhruba 200 000 tun.[3]
Průmyslové použití
Odhaduje se, že 70 % trichlortriazinu připadá na použití pro výrobu triazinových pesticidů, zejména atrazinu. Takové reakce jsou založeny na snadné náhradě chloridů nukleofily, například aminy:
- (ClCN)3 + 2 RNH2 → (RNHCN)(ClCN)2 + RNH3+Cl−
Podobně lze vyrábět další triazinové herbicidy, například simazin, anilazin nebo cyromazin.[4]
Trichlortriazin se využívá také jako prekurzor pro barviva a zesíťovací činidla. Největší třída těchto barviv jsou sulfonované triazin-stilbenové optické zjasňovače (OBA) čili fluorescenční bělidla (FWA), často používané v pracích prostředcích a bílém papíře.[3] Triazinový kruh je začleněn také v mnoha reaktivních barvivech. I tato se vyrábějí substitucí chloru jiným radikálem, jako v reakci popsané výše.[4]
Organická syntéza
V jedné specializované aplikace se trichlortriazin využívá jako reagens při konverzi alkoholů a karboxylových kyselin na alkyl-, resp. acylchloridy:[5]
Využívá se i jako dehydratační činidlo a pro aktivaci karboxylových kyselin při redukci na alkoholy. Zahříváním s dimethylformamidem vzniká Goldovo reagens Me2NCH=NCH=NMe2+Cl−, které je víceúčelovým zdrojem pro aminoalkylace a prekurzorem heterocyklických sloučenin.[6][7]
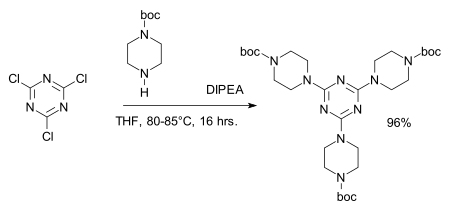
Chloridová centra lze snadno nahradit aminy za vzniku melaminových derivátů, například v syntéze dendrimerů:[8][9]
Trichlortriazin se využívá i při syntéze experimentálního ligandu adenosinového receptoru.[10]:
Reference
V tomto článku byl použit překlad textu z článku Cyanuric chloride na anglické Wikipedii.
- ↑ a b Cyanuric chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Cyanuric chloride at Chemicalland21.com
- ↑ a b Klaus Huthmacher, Dieter Most "Cyanuric Acid and Cyanuric Chloride" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a08_191.
- ↑ a b Ashford's Dictionary of Industrial Chemicals, 3rd edition, 2011, pages 2495-8
- ↑ K. Venkataraman, and D. R. Wagle. Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides. Tet. Lett.. 1979, s. 3037–3040. DOI 10.1016/S0040-4039(00)71006-9. (anglicky)
- ↑ Probst, D. A.; Hanson, P. R.; Barda, D. A. "Cyanuric Chloride" in Encyclopedia of Reagents for Organic Synthesis, 2004, John Wiley & Sons. DOI:10.1002/047084289X.rn00320
- ↑ JOHN T. GUPTON; STEVEN A. ANDREWS. β-Dimethylaminomethylenation: N,N-Dimethyl-N'-p-tolylformamidine. Org. Synth.. 1990. Dostupné online. (anglicky); Coll. Vol.. S. 197. (anglicky)
- ↑ Abdellatif Chouai and Eric E. Simanek. Kilogram-Scale Synthesis of a Second-Generation Dendrimer Based on 1,3,5-Triazine Using Green and Industrially Compatible Methods with a Single Chromatographic Step. J. Org. Chem.. 2008, s. 2357–2366. DOI 10.1021/jo702462t. PMID 18307354. (anglicky)
- ↑ Reagent: DIPEA, amine protective group: BOC
- ↑ 1,3,5-TRIAZINE DERIVATIVES AS LIGANDS FOR HUMAN ADENOSINE-A3 RECEPTORS. WO. Patentový spis 03101980. 2003-12-11. (Reagent number two: norephedrine, base DIPEA)
Externí odkazy
 Obrázky, zvuky či videa k tématu Trichlortriazin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Trichlortriazin na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Synthesis of acyl chloridescyanuric chloride K. Venkataraman, and D. R. Wagle (1979). "Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides". Tet. Lett. 20 (32): 3037–3040. DOI:10.1016/S0040-4039(00)71006-9.
chemical structure of cyanuric chloride
Autor: V8rik, Licence: CC BY-SA 3.0
Cyanuric chloride based dendrimer
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Autor: V8rik, Licence: CC BY-SA 3.0
synthesis of an experimental adenosine receptor ligand from Cyanuric chloride