Triethylboran
| Triethylboran | |
|---|---|
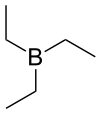 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | triethylboran |
| Ostatní názvy | triethylbor |
| Funkční vzorec | (C2H5)3B |
| Sumární vzorec | C6H15B |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 97-94-9 |
| EC-no (EINECS/ELINCS/NLP) | 202-620-9 |
| PubChem | 7357 |
| SMILES | B(CC)(CC)CC |
| InChI | InChI=1S/C6H15B/c1-4-7(5-2)6-3/h4-6H2,1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 97,993 g/mol |
| Teplota tání | −93 °C (180 K)[1] |
| Teplota varu | 95 °C (368 K)[1] |
| Hustota | 0,70 g/cm3 (23 °C)[1] |
| Index lomu | 1,3971[1] |
| Rozpustnost ve vodě | reaguje[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu[1] a tetrahydrofuranu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru[1] a hexanu |
| Tlak páry | 7,1 kPa[1] |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −194,6 kJ/mol (kapalina) −157,7 kJ/mol (plyn)[1] |
| Měrné teplo | 241,2 J⋅K−1⋅mol−1[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H250 H301 H314 H318 H330 H360}[1] |
| P-věty | P201 P202 P210 P222 P233 P240 P241 P242 P243 P260 P264 P270 P271 P280 P281 P284 P301+310 P301+330+331 P302+334 P303+361+353 P304+340 P305+351+338 P308+313 P310 P320 P321 P330 P363 P370+378 P403+233 P403+235 P405 P422 P501[1] |
Některá data mohou pocházet z datové položky. | |
Triethylboran (zkráceně TEB), také nazývaný triethylbor, je organická sloučenina patřící mezi organoborany, se vzorcem (C2H5)3B, zapisovaným též jako Et3B.
Příprava a struktura
Triethylboran se získává reakcí trimethylboritanu s triethylhliníkem:[2]
- Et3Al + (MeO)3B → Et3B + (MeO)3Al
Tato látka se vyskytuje v monomerní formě, čímž se liší od H3B a Et3Al, které vytváří dimery. BC3 jádro molekuly je rovinné.[2]
Použití
V tryskových motorech
Triethylboran se používal k zapalování paliva JP-7[3] v motorech Pratt & Whitney J58 letounu Lockheed SR-71 Blackbird a jeho předchůdce A-12 OXCART. Triethylboran je pro tento účel vhodný díky své samozápalnosti, obzvláště pak v důsledku vytváření velmi vysokých teplot. U Blackbirdu byl použit, protože palivo JP-7 má velmi nízkou těkavost a je obtížné jej zapálit.
V raketách
Ve směsi s 10 až 15 % triethylhliníku byl TEB použit ke spouštění motorů F-1 u raket Saturn V.[4]
V raketě Falcon 9 společnosti SpaceX se rovněž používá směs triethylhliníku a triethylboranu jako zápalná látka.[5]
V organické chemii
V průmyslu triethylboran slouží jako iniciátor při radikálových reakcích, kde je účinný i za velmi nízkých teplot.[2]
Jako iniciátor může nahradit některé organocínové sloučeniny.
Triethylboran reaguje s enoláty za vzniku enoxytriethylborátů, jež mohou být alkylovány na α-uhlíkových atomech selektivněji než za nepřítomnosti TBE, například enolát vzniklý reakcí cyklohexanonu s hydridem draselným poskytuje za přítomnosti TBE 2-allylcycklohexanon s 90% výtěžností, za jeho nepřítomnosti obsahuje výsledná směs 43 % monoallylovaného produktu, 31 % diallylovaných cyklohexanonů a 28 % nezreagovaného výchozího materiálu.[6] Druh použité zásady i teplota mají vliv na to, jestli vznikne stabilnější či méně stabilní enolát, což umožňuje volit místa, kam se navážou substituenty. Při použití 2-methylcyklohexanonu reagujícího s hydridem draselným a triethylboranem v THF za pokojové teploty vznikne více substituovaný a stabilnější enolát, než reakcí bis(trimethylsilyl)amidu draselného, KN[Si(CH3)3]2, s triethylboranem za −78 °C. První z těchto směsí může reagovat s jodmethanem za vzniku 2,2-dimethylcyklohexanonu s výtěžností 90 %, zatímco ze druhé vzniká 2,6-dimethylcyklohexanon, přičemž výtěžnost činí 93 %.[6][7]

Triethylbor se používá při Bartonových–McCombieových deoxygenacích alkoholů. Ve spojení s tri-terc-butoxyhydridem lithno-hlinitým zde štěpí ethery, například THF se, po hydrolýze, přeměňuje na butan-1-ol. TEB také spouští některé Reformatského reakce.[8]
Triethylboran je také prekurzorem redukčních činidel triethylborohydridu lithného a triethylborohydridu sodného.[9]
- MH + Et3B → MBHEt3 (M = Li, Na)
TEB reaguje s methanolem za tvorby diethyl(methoxy)boranu, který se používá jako chelatační činidlo při Narasakových–Prasadových redukcích, sloužících ke stereoselektivní přípravě syn-1,3-diolů z β-hydroxyketonů.[10][11]
Bezpečnost
Triethylboran je samozápalný, jeho teplota vznícení činí −20 °C.[12] Hoří zeleným plamenem charakteristickým pro sloučeniny boru. Obvykle se tak skladuje i používá za nepřístupu vzduchu. Triethylboran je také toxický při požití, LD50 zjištěná u krys má hodnotu 235 mg/kg.[13]
Odkazy
Související články
- Organoborany
- Pentaboran
Externí odkazy
 Obrázky, zvuky či videa k tématu Triethylboran na Wikimedia Commons
Obrázky, zvuky či videa k tématu Triethylboran na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Triethylborane na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m n https://pubchem.ncbi.nlm.nih.gov/compound/7357
- ↑ a b c Robert J. Brotherton; C. Joseph Weber; Clarence R. Guibert; John L. Little. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: Wiley-VCH, 2000-06-15. ISBN 3527306730. DOI 10.1002/14356007.a04_309. Kapitola Boron Compounds.
- ↑ Lockheed SR-71 Blackbird [online]. March Field Air Museum [cit. 2009-05-05]. Dostupné v archivu pořízeném z originálu dne 2000-03-04.
- ↑ A. Young. The Saturn V F-1 Engine: Powering Apollo Into History. [s.l.]: Springer, 2008. ISBN 978-0-387-09629-2. S. 86.
- ↑ Mission Status Center, June 2, 2010, 1905 GMT, SpaceflightNow, accessed 2010-06-02: "The flanges will link the rocket with ground storage tanks containing liquid oxygen, kerosene fuel, helium, gaseous nitrogen and the first stage ignitor source called triethylaluminum-triethylborane, better known as TEA-TEB."
- ↑ a b Handbook of Reagents for Organic Synthesis. Příprava vydání David Crich. [s.l.]: John Wiley & Sons, 2008. ISBN 9780470065365. Kapitola Enoxytriethylborates and Enoxydiethylboranes.
- ↑ Ei-ichi Negishi; Sugata Chatterjee. Highly regioselective generation of "thermodynamic" enolates and their direct characterization by NMR. Tetrahedron Letters. 1983, s. 1341–1344. DOI 10.1016/S0040-4039(00)81651-2.
- ↑ Yoshinori Yamamoto; Takehiko Yoshimitsu; John L. Wood; Laura Nicole Schacherer. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: Wiley, 2007-03-15. ISBN 978-0471936237. DOI 10.1002/047084289X.rt219.pub3. Kapitola Triethylborane.
- ↑ P. Binger; R. Köster. Sodium triethylhydroborate, sodium tetraethylborate, and sodium triethyl-1-propynylborate. Inorganic Syntheses. 1974, s. 136–141. ISBN 9780470132463. DOI 10.1002/9780470132463.ch31.
- ↑ Kau-Ming Chen; Karl G. Gunderson; Goetz E. Hardtmann; Kapa Prasad; Oljan Repic; Michael J. Shapiro. A Novel Method for the In situ Generation of Alkoxydialkylboranes and Their Use in the Selective Preparation of 1,3-syn Diols. Chemistry Letters. 1987, s. 1923–1926. DOI 10.1246/cl.1987.1923.
- ↑ Yang Jaemoon. Six-Membered Transition States in Organic Synthesis. [s.l.]: John Wiley & Sons, 2008. ISBN 9780470199046. Kapitola Diastereoselective Syn-Reduction of β-Hydroxy Ketones, s. 151–155.
- ↑ Fuels and Chemicals - Autoignition Temperatures
- ↑ Safety Data Sheet
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Chemical structure of triethylborane (triethyl borane)
Skeletal structures for the reaction of 2-methylcyclohexanone with various bases (potassium bis(trimethylsilyl)amide (KHMDS) or potassium hydride) followed by triethylborane to form two different enolates. A subsequent reaction with iodomethane gives different methylated structural isomers depending on the enolate position.)










