Triethyloxoniumtetrafluoroborát
| Triethyloxoniumtetrafluoroborát | |
|---|---|
 Strukturní vzorec | |
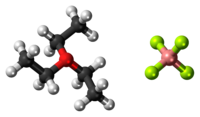 Model molekuly | |
| Obecné | |
| Systematický název | triethyloxidanium-tetrafluoridoborát |
| Ostatní názvy | triethyloxoniumtetrafluoroborát, Meerweinova sůl |
| Sumární vzorec | C6H15BF4O |
| Identifikace | |
| Registrační číslo CAS | 368-39-8 |
| EC-no (EINECS/ELINCS/NLP) | 206-705-1 |
| PubChem | 2723982 |
| SMILES | F[B-](F)(F)F.CC[O+](CC)CC |
| Vlastnosti | |
| Molární hmotnost | 189,99 g/mol |
| Teplota tání | 91 až 92 °C (264 až 265 K) |
| Rozpustnost ve vodě | reaguje |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H314[1] |
| P-věty | P260 P264 P280 P301+330+331 P303+361+353 P304+340 P305+351+338 P310 P321 P363 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Triethyloxoniumtetrafluoroborát (také se používá název Meerweinova sůl nebo Meerweinovo činidlo) je organická sloučenina se vzorcem [(CH3CH2)3O]BF4. Objevil ji německý chemik Hans Meerwein.[2][3] Podobnou látkou je trimethyloxoniumtetrafluoroborát, který je rovněž bílou pevnou látkou rozpustnou v polárních organických rozpouštědlech a také jde o silné alkylační činidlo. Komerčně dostupných je i několik dalších solí tetrafluorboritanového aniontu.[4]
Příprava a reakce
Triethyloxoniumtetrafluoroborát se připravuje reakcí fluoridu boritého, diethyletheru a epichlorhydrinu:[5]
- 4 Et2O·BF3 + 2 Et2O + 3 C2H3(O)CH2Cl → 3 Et3O+BF −
4 + B[(OCH(CH2Cl)CH2OEt]3
Trimethyloxoniovou sůl lze podobným způsobem získat z dimethyletheru.[6] Obě látky jsou nestabilní a podléhají hydrolýze:
- [(CH3CH2)3O]+BF −
4 + H2O → (CH3CH2)2O + CH3CH2OH + HBF4
Náchylnost trialkyloxoniových solí k alkylové výměně lze využít několika způsoby; například trimethyloxoniumtetrafluoroborát, který kvůli špatné rozpustnosti ve většině rozpouštědel reaguje pomalu, může být přeměněn na trialkyloxoniové soli s delšími alkylovými řetězci, které se rozpouštějí lépe, čímž se reakce urychlí.[7]
Struktura
Molekula této látky se skládá z pyramidálního oxoniového kationtu, který je isoelektronický s triethylaminem, a tetraedrického fluorboritanového aniontu. Jelikož jde o iontovou sloučeninu, tak se rozpouští v polárních inertních rozpouštědlech, jako jsou dichlormethan, oxid siřičitý a nitromethan.
Bezpečnost
Triethyloxoniumtetrafluoroborát je silné alkylační činidlo, jeho nebezpečnost však snižuje skutečnost, že nejde o těkavou látku. Při kontaktu s vodou uvolňuje silné kyseliny. Trimethyloxoniumtetrafluoroborát má podobné vlastnosti.
Reference
V tomto článku byl použit překlad textu z článku Triethyloxonium tetrafluoroborate na anglické Wikipedii.
- ↑ a b c d Triethyloxonium tetrafluoroborate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ H. Meerwein; G. Hinz; P. Hofmann; E. Kroning; E. Pfeil. Über Tertiäre Oxoniumsalze, I. Journal für Praktische Chemie. 1937, s. 257. DOI 10.1002/prac.19371471001.
- ↑ H. Meerwein; E. Bettenberg; H. Gold; E. Pfeil; G. Willfang. Über Tertiäre Oxoniumsalze, II. Journal für Praktische Chemie. 1940, s. 83. DOI 10.1002/prac.19391540305.
- ↑ Hartwig Perst, Dave G. Seapy "Triethyloxonium Tetrafluoroborate" in Encyclopedia of Reagents for Organic Synthesis John Wiley & Sons, New York, 2008. DOI:10.1002/047084289X.rt223.pub2. Article Online Posting Date: March 14, 2008
- ↑ H. MEERWEIN. Triethyloxonium fluoroborate. Org. Synth.. 1973. Dostupné online. (anglicky); Coll. Vol.. S. 1080. (anglicky)
- ↑ T. J. CURPHEY. Trimethyloxonium tetrafluoroborate. Org. Synth.. 1988. Dostupné online. (anglicky); Coll. Vol.. S. 1019. (anglicky)
- ↑ A. P. Vartak; P. A. Crooks. A Scalable Enantioselective synthesis of the alpha2-adrenergic Agonist, Lofexidine. Organic Process Research & Development. 2009, s. 415–419. DOI 10.1021/op8002689.
Externí odkazy
 Obrázky, zvuky či videa k tématu Triethyloxoniumtetrafluoroborát na Wikimedia Commons
Obrázky, zvuky či videa k tématu Triethyloxoniumtetrafluoroborát na Wikimedia Commons
Média použitá na této stránce
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the component ions in triethyloxonium tetrafluoroborate, an alkylating agent consisting of a triethyloxonium cation (left) and a tetrafluoroborate anion (right).
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Oxygen, O: red
- Boron, B: pink
- Yellow-green: Fluorine, F
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Triethyloxoniumtetrafluorborat



