Trifenylfosfinoxid
| Trifenylfosfinoxid | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
 | |
| Obecné | |
| Systematický název | Trifenyl-λ5-fosfanon |
| Sumární vzorec | C18H15OP |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 791-28-6 |
| PubChem | 13097 |
| ChEBI | 36601 |
| SMILES | O=P(c1ccccc1)(c2ccccc2)c3ccccc3 |
| InChI | InChI=1S/C18H15OP/c19-20(16-10-4-1-5-11-16,17-12-6-2-7-13-17)18-14-8-3-9-15-18/h1-15H |
| Vlastnosti | |
| Molární hmotnost | 278,28 g/mol |
| Teplota tání | 154 až 158 °C (427 až 431 K) |
| Teplota varu | 360 °C (633 K) |
| Hustota | 1,212 g/cm3 |
| Rozpustnost ve vodě | málo rozpustný |
| Rozpustnost v polárních rozpouštědlech | rozpustný v polárních organických rozpouštědlech |
| Bezpečnost | |
| [1] Varování[1] | |
Některá data mohou pocházet z datové položky. | |
Trifenylfosfinoxid je organická sloučenina se vzorcem OP(C6H5)3. Je vedlejším produktem reakcí, při kterých se používá trifenylfosfin a používá se k usnadnění krystalizace některých sloučenin.
Struktura a vlastnosti
Trifenylfosfinoxid vytváří čtyřstěnné molekuly podobné jako oxychlorid fosforečný.[2] Kyslíkový atom vykazuje vlastnosti zásady. Díky nízké reaktivitě hlavního řetězce a zásaditosti kyslíkového atomu je oblíbenou látkou usnadňující krystalizaci molekul s kyselými atomy vodíku, jako jsou například fenoly.[3]
Je známo několik krystalových modifikací trifenylfosfinoxidu, jednou z nich je jednoklonná s prostorovou grupou P21/c, Z = 4, a = 1506,6(1) pm, b = 903,7(2) pm, c = 1129,6(3) pm, a β = 98,47(1)°.[4] Existuje také kosočtverečná forma, která má prostorovou grupu Pbca, kde Z = 4, a = 2908,9(3) pm, b = 913,47(9) pm a c = 1126,1(1) pm.[5]
Vznik v organické syntéze
Trifenylfosfinoxid je vedlejším produktem mnoha reakcí používaných v organické syntéze, jako jsou Wittigova, Staudingerova a Micunobova reakce. Vytváří se také při používání trifenylfosfindichloridu k přeměně alkoholů na alkylchloridy:
- (C6H5)3PCl2 + ROH → (C6H5)3PO + HCl + RCl
Trifenylfosfin lze z oxidu získat reakcemi s deoxygenačními činidly, jako jsou fosgen nebo trichlorsilan:[6]
- (C6H5)3PO + SiHCl3 → P(C6H5)3 + 1/n (OSiCl2)n + HCl
Odstranění trifenylfosfinoxidu z reakčních směsí pomocí chromatografie bývá obtížné, díky jeho nízké rozpustnosti v hexanu a chladném diethyletheru jej však často lze chromatograficky odstranit pomocí těchto látek. Nejprve se provede přeměna na hořečnatý komplex, který je špatně rozpustný v toluenu a dichlormethanu, a ten se odfiltruje.[7] Při jiné metodě se místo toho přidává chlorid zinečnatý, který může být použit i s polárnějšími rozpouštědly, jako jsou ethanol, ethylacetát a tetrahydrofuran.[8]
Koordinační chemie
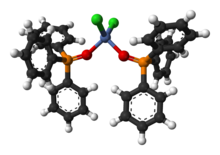
C6H5)3PO může vytvářet komplexy s „tvrdými“ ionty kovů. Příkladem může být NiCl2(OP(C6H5)3)2.[9]
Trifenylfosfinoxid je běžnou nečistotou v trifenylfosfinu, kde vzniká oxidací, kterou mohou katalyzovat ionty mnoha kovů:
- 2 P(C6H5)3 + O2 → 2 (C6H5)3PO
Reference
V tomto článku byl použit překlad textu z článku Triphenylphosphine oxide na anglické Wikipedii.
- ↑ a b Triphenylphosphine oxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" 5th Edition Elsevier: Amsterdam. ISBN 0-444-89307-5.
- ↑ M. C. Etter; P. W. Baures. Triphenylphosphine oxide as a crystallization aid. Journal of the American Chemical Society. 1988, s. 639–640.
- ↑ Anthony L. Spek. Structure of a second monoclinic polymorph of triphenylphosphine oxide. Acta Crystallographica. 1987, s. 1233–1235.
- ↑ Khalid A. Al-Farhan. Crystal structure of triphenylphosphine oxide. Journal of Crystallographic and Spectroscopic Research. 1992, s. 687–689.
- ↑ H. A. van Kalkeren; F. L. van Delft; F. P. J. T. Rutjes. Organophosphorus Catalysis to Bypass Phosphine Oxide Waste. ChemSusChem. 2013, s. 1615–1624.
- ↑ Patent WO 1998007724. "Process for the preparation of 7-alkoxyalkyl-1,2,4-triazolo[1,5-a] pyrimidine derivatives"
- ↑ Donald C. Batesky; Matthew J. Goldfogel; Daniel J. Weix. Removal of Triphenylphosphine Oxide by Precipitation with Zinc Chloride in Polar Solvents. The Journal of Organic Chemistry. 2017, s. 9931–9936.
- ↑ D. M. L. Goodgame; M. Goodgame. Near-Infrared Spectra of Some Pseudotetrahedral Complexes of Cobalt (II) and Nickel(II). Inorganic Chemistry. 1965, s. 139–143.
Externí odkazy
 Obrázky, zvuky či videa k tématu Trifenylfosfinoxid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Trifenylfosfinoxid na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Ball-and-stick model of the dichlorobis(triphenylphosphine oxide)nickel(II) complex, (Ph3PO)2NiCl2, as found in the crystal structure.
X-ray crystallographic data from Acta Cryst. (2004). E60, m1861-m1862.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Space-filling model of the triphenylphosphine oxide molecule, Ph3PO, as found in the crystal structure.
X-ray crystallographic data from K. A. Al-Farhan (1992). J. Cryst. Spect. Res., 22(6), 687–689.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Autor: Milda 444, Licence: CC BY-SA 4.0
Syntetizovaný trifenylfosfinoxid; Fotografováno na SPŠCHBR





