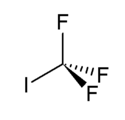
Trifluorjodmethan
| Trifluorjodmethan | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | trifluor(jod)methan |
| Sumární vzorec | CF3I |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 2314-97-8 |
| PubChem | 16843 |
| SMILES | FC(F)(F)I |
| InChI | 1/CF3I/c2-1(3,4)5 |
| Vlastnosti | |
| Molární hmotnost | 195,91 g/mol |
| Teplota tání | −110 °C (163 K) |
| Teplota varu | −22,56 °C (250,6 K) |
| Hustota | 2,5485 g/cm3 (-78,5 °C) 2,3608 g/cm3 (-32,5 °C) |
| Rozpustnost ve vodě | málo rozpustný |
| Tlak páry | 541 kPa |
| Bezpečnost | |
| [1] Varování[1] | |
| H-věty | H341[1] |
| P-věty | P201 P202 P281 P308+313 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Trifluorjodmethan je organická sloučenina, halogenovaný derivát methanu. Je možnou náhradou bromtrifluormethanu jako hasiva či chladiva. Lze jej použít k hašení požárů v letadlech a při požárech elektronických zařízení.
Použití a vlastnosti
Trifluorjodmethan se používá při α trifluormethylaci α,β-nenasycených ketonů.[2]
Je možnou složkou nové generace hasiv, ve kterých nahrazuje bromtrifluormethan.[3] Mechanismus účinku této látky spočívá hlavně v zamezení řetězové reakce v plamenu „negativní katalýzou“.[4] Rovněž může sloužit jako náhrada fluoridu sírového v elektronickém průmyslu.[5]
Reakce
Na světle a nebo při teplotách nad 100 °C reaguje tfifluorjodmethan s vodou za vzniku nebezpečných produktů jako jsou fluorovodík (HF), jodovodík (HI) a karbonylfluorid (COF2).
Vliv na životní prostředí
V molekule trifluorjodmethanu se nacházejí atomy uhlíku, fluoru a jodu. I když jod poškozuje ozonovou vrstvu několikasetkrát účinněji než chlor, tak se vazba C-I díky své nízké energii a vysoké elektronegativitě fluoru snadno rozpadá působením vody a trifluorjodmethan tak má oproti bromtrifluormethanu více než tisíckrát menší potenciál k ničení ozonové vrstvy (0,008 až 0,01). V atmosféře se rozpadne za méně než 1 měsíc, tedy za méně než setinu času oproti bromtrifluormethanu, což je dokonce méně než u chlorovodíku uvolňovaného ze sopek.
Vazby C-F absorbují infračervené záření.[6] Potenciál globálního oteplování je však u této látky jen asi 0,4, tedy o 60 % nižší, než u oxidu uhličitého.[7]
Reference
V tomto článku byl použit překlad textu z článku Trifluoroiodomethane na anglické Wikipedii.
- ↑ a b c d Trifluoroiodomethane. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Trifluoroiodomethane 171441 [online]. [cit. 2017-09-06]. Dostupné online. (anglicky)
- ↑ Fire extinguishing agents trifluoroiodomethane/CF3I [online]. [cit. 2018-09-20]. Dostupné online. (anglicky)
- ↑ CFI rim seal fire protection for floating roof tanks [online]. [cit. 2018-09-20]. Dostupné v archivu pořízeném dne 2018-09-21. (anglicky)
- ↑ Investigation of the Performance of CF3I Gas as a Possible Substitute for SF6 [online]. [cit. 2018-09-20]. Dostupné online. (anglicky)
- ↑ T. Shimanouchi. Methane, trifluoroiodo-. webbook.nist.gov. 1972, s. 993–1102. Dostupné online. (anglicky)
- ↑ Birgit Ramfjord. Listing of GWP Values as per Report IPCC WG1 AR4 [online]. Swedish Defence Materiel Administration [cit. 2017-09-07]. Dostupné v archivu pořízeném z originálu. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Trifluorjodmethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Trifluorjodmethan na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Created using: ACD/ChemSketch