Trifluormethylace
Trifluormethylace je v organické chemii obecně jakákoliv reakce, při níž dochází k připojení trifluormethylové skupiny na organickou sloučeninu.[1][2][3][4]
Trifluormethylované sloučeniny mají určitý význam při výrobě léčiv a agrochemikálií; příklady takových léčiv jsou fluoxetin, leflunomid, nulitamid, dutasterid, fipronil, fluazinam, fluridon a triflurazin, u agrochemikálií například trifluralin.
Historie
První výzkum trifluormethylových skupin, obzvláště jejich biologické aktivity, byl proveden roku 1927.[5] Další podobný výzkum proběhl v roce 1958.[6] Trifluormethgylační reakci popsal roku 1892 Frédéric Swarts,[7] zde šlo o reakci založenou na fluoridu antimonitém. Při tomto postupu reaguje benzotrichlorid s SbF3 za vzniku C6H5CF2Cl a C6H5CF3. Ve 30. letech 20. století byl SbF3 nahrazen fluorovodíkem. Při McLoughlinově-Throwerově reakci, vyvinuté v roce 1968, se používají jodfluoralkany, jodované aromatické sloučeniny a měď.[8] Roku 1969 byla popsána další metoda, při níž docházelo k trifluormethylaci.[9][10]
 |
| McLoughlinova-Throwerova reakce (1968) |
Činidla
Trifluormethyltrimethylsilan
Přípravu trifluormethyltrimethylsilanu popsal Ingo Ruppert roku 1984.[11] V roce 1989 byla zmíněna aktivace TMSCF3 fluoridem za úřelem provedení nukleofilní trifluormethylace karbonylových sloučenin.[12] V témže roce byla popsána také obdobná reakce sloužící k přípravě trifluormethylovaných fenolů a anilinů[13] a od té doby je TMSCF3 běžně používaným nukleofilním trifluormethylačním činidlem.[14][15]
Jako příklad lze uvést trifluormethylaci cyklohexanonu v tetrahydrofuranu pomocí tetrabutylamoniumfluoridu.[16]
 |
| Trifluormethylace za použití trifluormethyltrimethylsilanu[16] |
Substráty mohou být arylhalogenidy.[17][18] (Trifluormethyl)trimethoxyboritan draselný použitý při těchto reakcích se získává z B(OMe)3, CF3SiMe3 a fluoridu draselného.[19]
Byla také popsána reakce s využitím funkcionalizace arylů aktivací vazeb C-H.[20][21]
Trifluoroctan sodný
Trifluoroctan sodný byl jako reaktant při trifluormethylacích poprvé použit v roce 1981; substráty byly arylhalogenid s jodidem měďným.[22][23]
Trifluormethan
Fluoroform (CF3H) byl použit jako činidlo k trifluormethylaci aldehydů za přítomnosti silné zásady.[24]
 |
| Trifluoromethylace za použití fluoroformu[24] |
Trifluorjodmethan
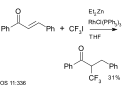
Trifluorjodmethan se používá jako reaktant při aromatických párovacích reakcích a rovněž při reakcích enonů (například chalkonu) s diethylzinkem za přítomnosti Wilkinsonova katalyzátoru:[25]
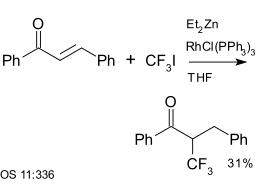 |
| Trifluormethylace za použití diethylzinku a Wilkinsonova katalyzátoru[25] |
Trifluormethylsulfon a trifluormethylsulfoxid
K trifluormethylaci elektrofilů lze použít trifluormethylsulfon (C6H5SO2CF3) nebo trifluormethylsulfoxid (C6H5SOCF3).[26]
Trifluormethansulfonylchlorid
Trifluormethansulfonylchlorid (CF3SO2Cl, také nazývaný triflylchlorid) je možné velmi účinně použít na trifluormethylaci aromatických a heteroaromatických molekul, včetně některých léčiv. Při této reakci se používá fotoredoxní katalyzátor a zdroj světla; vše probíhá při pokojové teplotě.[27]
Trifluormethansulfinát sodný
Trifluormethansulfinát sodný (CF3SO2Na) byl jako trifluormethylační činidlo poprvé použit v roce 1991.[28] Při tomto procesu je nutné použití terc-butylhydroperoxidu a většinou i kovu; reakce probíhá radikálovým mechanismem. Uvedený reaktant je možné použít i na heterocyklické substráty.[29]
 |
| Trifluormethylace pomocí trifluormethansulfinátu sodného[29] |
Umemotova činidla
Umemotova činidla jsou (trifluormethyl)dibenzoheterocyklické soli.[30][31]
Organokovové sloučeniny
Byla připravena řada kovových komplexů obsahujících skupinu CF3-, přičemž některé z nich se hodí k trifluormethylaci. Patří k nim například (trifluormethyl)lithium (CF3Li), jež lze připravit iontoměniči; ovšem i za nízkých teplot je nestabilní, rozkládá se na fluorid lithný a difluorkarben. Vhodnější vlastnosti vykazují trifluormethylměďnatá činidla ; ty se připravují přímo na místě reakcí trifluormethyljodidu (CF3I) s práškovou mědí v polárních rozpouštědlech.[32] Hg(CF3)2, prepared by decarboxylation of the trifluoroacetate, has proven useful for the trifluoromethylation of other metals.[33]
Typy trifluormethylačních reakcí
Aromatické párovací reakce
U párovacích reakcí aromatických sloučenin s trifluormethyl-kovovými komplexy se jako katalyzátor obvykle používá měď, palladium a nikl jsou méně časté.[1] Při McLoughlinově-Throwerově reakci (vyvinuté roku 1962) reaguje jodbenzen s trifluorjodmethanem (CF3I) a práškovou mědí v dimethylformamidu při 150 °C a tvoří se trifluormethylbenzen; meziproduktem je přitom perfluormethyl-kovový komplex.
V reakci, popsané roku 1982, katalyzované octanem palladnatým se používá práškový zinek, meziproduktem by měl být CF3ZnI, aktivním katalyzátorem je kovové palladium.[34][35]
První párovací reakce katalyzovaná mědí byla popsána v roce 2009, použity byly aryljodidy, trifluormethylsilan, jodid měďný a 1,10-fenantrolin.[36] Jako donor CF3 lze použít též (trifluormethyl)trimethoxyboritan draselný,[37] arylborité kyseliny,[38][39] soli trifluormethylsulfonových kyselin[40] nebo fenntrolin-trifluormethylměďný komplex.[41]
Roku 2010 byla popsána reakce arylhalogenidů, (trifluormethyl)triethylsilanu a dimeru allylpalladiumchloridu katalyzovaná palladiem.[42]
 |  |
| Aromatická trifluormethylace popsaná roku 1982[34] | Aromatická trifluormethylace popsaná roku 2009[36] |
Radikálová trifluormethylace
Při radikálové trifluormethylaci je aktivní látkou trifluormethylový radikál;[43] jako činidla se nejčastěji používaly bromtrifluormethan a haloformy,[44][45] ovšem s ohledem na Montrealský protokol byly vyvinuty alternativy jako například trifluorjodmethan;[46][47] používá se také směs trifluorjodmethanu a triethylboranu[48][49] nebo trifluormethansulfinát sodný a bis(trifluoracetyl)peroxid.
 |
| Trifluormethylace za použití CF3I a triethylboranu Zásadou je 2,6-lutidin[48] |
V radikálu CF3 je atom fluoru, díky indukčnímu efektu a omezené možnosti odevzdat elektron, skupinou odtahující elektrony. Na rozdíl od methylového radikálu má čtyřstěnný tvar s velkou přechodovou bariérou, disponuje větší elektrofilitou a je též reaktivnější (například při reakci se styrenem 440krát[50]). V roce 1949 byla popsána fotochemická reakce trifluorjodmethanu s ethenem za vzniku 3-jod1,1,1-trifluorpropanu.[51]
K látkám či směsím, o kterých je známo, že mohou být použity na přímou trifluormethylaci arenů, patří CF3I, CF3Br, trifluoroctan stříbrný s TiO2 a trifluormethansulfinát sodný s Cu(OSO2CF3)2/tBuOOH.
Nukleofilní trifluormethylace
V nukleofilní trifluormethylaci je aktivní látkou anion CF -
3 ,[52] o kterém se však předpokládá, že je pouze přechodným produktem a tak jej není možné izolovat, i když byla zachycena a popsána jeho sloučenina s kationtem [K(18-crown-6)]+.[53]
Pozorování trifluormethyového aniontu je obtížné z důvodu jeho silně zásadité povahy a snahy vytvořit pětinásobně koordinované sloučeniny s křemíkem, například [(CH3)3Si(CF3)2]− nebo [(CH3)3Si(F)(CF3)]−; příkladem může být reaktivita fluoroformu za přítomnosti silné zásady jako je terc-butoxid draselný s karbonylovými sloučeninami v dimethylformamidu (DMF),[52] kdy CF -
3 reaguje s DMF za vzniku hemiaminolátového aduktu.([Me2NCH(O)CF3]K).[24][54][55][56]
 |
| Trifluormethylace s využitím methylfluorsulfonyldifluoroctanového aniontu; |
Elektrofilní trifluormethylace
Při elektrofilní trifluormethylaci má donor trifluormethylové skupiny kladný náboj.[58][59] Tvorba kationtu CF +
3 byla označena za „velmi obtížnou“.[60] První odpovídající činidla, diaryl(trifluoromethyl)sulfoniové soli (Ar2S+CF3SbF6−) byla připravena roku 1984 reakcí aryltrifluormethylsulfoxidu 1 s SF 3
+ SbF −
6 následovanou reakcí s arenem bohatým na elektrony.[61] tato látka se používala k trifluormethylaci thiofenolátů. Tetrafluorboritan S-(trifluormethyl)dibenzothiofenia představuje komerčně dostupné trifluormethylační činidlo fungující stejným způsobem; poprvé byl připraven v roce 1990.[62][63] U tohoto druhu sloučenin může být síra nahrazena kyslíkem, selenem nebo tellurem. Jako substráty je možné použít například pyridin, anilin, trifenylfosfin a lithnou sůl fenylacetylenu.
 | 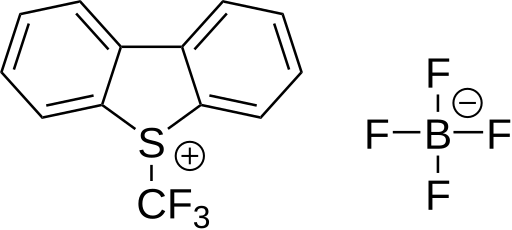 |  |
| 5-(trifluormethyl)dibenzothiofeniumtrifluormethansulfonát | Tetrafluorboritan 5-(trifluormethyl)dibenzothiofenia | 3,3-dimethyl-1-(trifluormethyl)-1,2-benziodoxol |
Další skupinou donorů trifluormethylové skupiny jsou hypervalentní sloučeniny CF3 s trojmocným jodem jako například 3,3-dimethyl-1-(trifluoromethyl)-1,2-benziodoxol.[64][65][66][67] Substráty zde mohou být thioly, alkoholy, fosfiny, areny,[68] neaktivované alkeny[69] a nenasycené karboxylové kyselny.[70]
 |
| Trifluormethylace na thiolové skupině pomocí hypervalentního jodu[68] |
Asymetrická trifluormethylace
Během asymetrické trifluormethylace se trifluormethylová skupina na substrát připojuje enantioselektivně.[71][72] K dosažení enantioselektivity lze použít Ruppertova činidlo, s nímž je možné připravit deriváty chirálních aminokyselin,[73] sacharidů[74] a steroidů. Jako katalyzátory se také používají chirální amoniumfluoridy.[75][76] K prvním popsaným elektrofilním asymetrickým trifluormethylacím patří například reakce enolátů kovů s trifluormethylchlakogenovými solemi za přítomnosti chirálního katalyzátoru s obsahem boru.[77]
 | 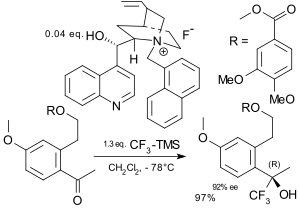 | |
| Asymetrická trifluorace popsaná v roce 1994[75] | Asymetrická trifluorace popsaná v roce 2003[76] |
Později byly objeveny velmi enantioselektivní metody α trifluormethylace aldehydů karbonylových sloučenin pomocí fotoredoxních katalyzátorů, například tris(bipyridin)chloridu ruthenatého[78] nebo jodonia.[79] Trifluormethylaci je možné provést i u β ketoesterů[80] a též u enolátů zirkonia, v tomto případě probíhá jako radikálová adice, katalyzovaná sloučeninami ruthenia.[81]
Reference
V tomto článku byl použit překlad textu z článku Trifluoromethylation na anglické Wikipedii.
- ↑ a b O. A. Tomashenko; V. V. Grushin. Aromatic Trifluoromethylation with Metal Complexes. Chemical Reviews. 2011, s. 4475–4521.
- ↑ T. Furuya; A. S. Kamlet; T. Ritter. Catalysis for fluorination and trifluoromethylation. Nature. 2011, s. 470–477. Bibcode 2011Natur.473..470F.
- ↑ T. Besset; C. D. Schneider; D. Cahard. Tamed Arene and Heteroarene Trifluoromethylation. Angewandte Chemie International Edition. 2012, s. 5048–5050. PMID 22488902.
- ↑ C. N. Alonso; E. Martínez De Marigorta; G. Rubiales; F. Palacios. Carbon Trifluoromethylation Reactions of Hydrocarbon Derivatives and Heteroarenes. Chemical Reviews. 2015, s. 1847–1935. PMID 25635524.
- ↑ Lehmann, F. Chemical constitution and activity. Aromatic fluorine compounds. Arch. exp. Pathol. Pharmakol 130 (1928): 250-255.
- ↑ H. L. Yale. The Trifluoromethyl Group in Medical Chemistry. Journal of Medicinal and Pharmaceutical Chemistry. 1959, s. 121–133.
- ↑ Frédéric Swarts. Acad. Roy. Belg. 1892, s. 474.
- ↑ V. C. R. McLoughlin; J. Thrower. A route to fluoroalkyl-substituted aromatic compounds involving fluoroalkylcopper intermediates. Tetrahedron. 1969, s. 5921–5940.
- ↑ Y. Kobayashi; I. Kumadaki. Trifluoromethylation of aromatic compounds. Tetrahedron Letters. 1969, s. 4095–4096.
- ↑ B. T. Folléas; I. Marek; J. F. Normant; L. Saint-Jalmes. Fluoroform: An Efficient Precursor for the Trifluoromethylation of Aldehydes. Tetrahedron. 2000, s. 275–283.
- ↑ Ingo Ruppert; Klaus Schlich; Wolfgang Volbach. Die ersten CF3-substituierten organyl(chlor)silane. Tetrahedron Letters. 1984, s. 2195–2198. (německy)
- ↑ G. K. Surya Prakash; Ramesh Krishnamurti; George Andrew Olah. Synthetic methods and reactions. 141. Fluoride-induced trifluoromethylation of carbonyl compounds with trifluoromethyltrimethylsilane (TMS-CF3). A trifluoromethide equivalent. Journal of the American Chemical Society. 1989, s. 393–395.
- ↑ G. Patrick Stahly; Donald R. Bell. A new method for synthesis of trifluoromethyl-substituted phenols and anilines. The Journal of Organic Chemistry. 1989, s. 2873–2877.
- ↑ G. K. Surya Prakash; Andrei K. Yudin. Perfluoroalkylation with Organosilicon Reagents. Chemical Reviews. 1997, s. 757–786. PMID 11848888.
- ↑ Xiao Liu; Cong Xu; Mang Wang; Qun Liu. Trifluoromethyltrimethylsilane: Nucleophilic Trifluoromethylation and Beyond. Chemical Reviews. 2015, s. 683–730. PMID 24754488.
- ↑ a b Pichika Ramaiah; Ramesh Krishnamurti; K. Surya Prakash. 1-TRIFLUOROMETHYL-1-CYCLOHEXANOL. Organic Syntheses. 1995, s. 232.
- ↑ H. Morimoto; T. Tsubogo; N. D. Litvinas; J. F. Hartwig. A Broadly Applicable Copper Reagent for Trifluoromethylations and Perfluoroalkylations of Aryl Iodides and Bromides. Angewandte Chemie. 2011, s. 3877–3882.
- ↑ Masahiro Oishi; Hideaki Kondo; Hideki Amii. Aromatic trifluoromethylation catalytic in copper. Chemical Communications. 2009, s. 1909–1911.
- ↑ T. Knauber; F. Arikan; G.-V. Röschenthaler; L. J. Gooßen. Copper-Catalyzed Trifluoromethylation of Aryl Iodides with Potassium (Trifluoromethyl)trimethoxyborate. Chemistry: A European Journal. 2011, s. 2689–2697. PMID 21274956.
- ↑ Yingda Ye; Shin Hee Lee; Melanie S. Sanford. Silver-Mediated Trifluoromethylation of Arenes Using TMSCF3. Sanford Organic Letters. 2011, s. 5464–5467.
- ↑ A. Hafner; S. Bräse. Ortho-Trifluoromethylation of Functionalized Aromatic Triazenes. Angewandte Chemie International Edition. 2012, s. 3713–3715.
- ↑ Kiyohide Matsui; Etsuko Tobita; Midori Ando; Kiyosi Kondo. A convenient trifluoromethylation of aromatic halides with sodium trifluoroacetate. Chemistry Letters. 1981, s. 1719–1720.
- ↑ Bernard R. Langlois; Nicolas Roques. Nucleophilic trifluoromethylation of aryl halides with methyl trifluoroacetate. Journal of Fluorine Chemistry. 2007, s. 1318–1325.
- ↑ a b c Benoît Folléas; Ilan Marek; Jean-F. Normant; Laurent Saint Jalmes. Fluoroform: an efficient precursor for the trifluoromethylation of aldehydes. Tetrahedron Letters. 1998, s. 2973–2976.
- ↑ a b Kazuyuki Sato; Masaaki Omote; Akira Ando; Itsumaro Kumadaki. TRIFLUOROMETHYLATION AT THE a-POSITION OF b,b-UNSATURATED KETONES: 4-PHENYL-3-(TRIFLUOROMETHYL)BUTAN-2-ONE. Organic Syntheses. 2006, s. 177.
- ↑ G. K. Surya Prakash; Jinbo Hu; George Andrew Olah Olah. Alkoxide- and Hydroxide-Induced Nucleophilic Trifluoromethylation Using Trifluoromethyl Sulfone or Sulfoxide. Organic Letters. 2003, s. 3253–3256.
- ↑ David A. Nagib; David W. C. MacMillan. Trifluoromethylation of arenes and heteroarenes by means of photoredox catalysis. Nature. 8. 12. 2011, s. 224–228. PMID 22158245. Bibcode 2011Natur.480..224N.
- ↑ Bernard R. Langlois; Eliane Laurent; Nathalie Roidot. Trifluoromethylation of aromatic compounds with sodium trifluoromethanesulfinate under oxidative conditions. Tetrahedron Letters. 1991, s. 7525–7528.
- ↑ a b Y. Ji; T. Brueckl; R. D. Baxter; Y. Fujiwara; I. B. Seiple; S. Su; D. G. Blackmond. Innate C-H trifluoromethylation of heterocycles. Proceedings of the National Academy of Sciences. 15. 8. 2011, s. 14 411–14 415. PMID 21844378. Bibcode 2011PNAS..10814411J.
- ↑ Cai Zhang. Recent advances in trifluoromethylation of organic compounds using Umemoto's reagents. Organic & Biomolecular Chemistry. 11. 7. 2014, s. 6580.
- ↑ Huiqin Li. Umemoto's Reagent. Synlett. 3. 9. 2012, s. 2289–2290.
- ↑ Donald J. Burton, Long Lu "Fluorinated Organometallic Compounds" Topics in Current Chemistry, 1997, Vol. 193, p. 45.
- ↑ Reint Eujen "Bis(Trifluoromethyl)Mercury" 1986, volume 24, p. 52. DOI:10.1002/9780470132555.ch16
- ↑ a b Tomoya Kitazume; Nobuo Ishikawa. PALLADIUM-CATALYZED CROSS-COUPLING REACTIONS BETWEEN ALLYL, VINYL OR ARYL HALIDE AND PERFLUOROALKYL IODIDE WITH ZINC AND ULTRASONIC IRRADIATION. Chemistry Letters. 1982, s. 137–140.
- ↑ Tomoya Kitazume; Nobuo Ishikawa. Ultrasound-promoted selective perfluoroalkylation on the desired position of organic molecules. Journal of the American Chemical Society. 1985, s. 5186–5191.
- ↑ a b M. Oishi; H. Kondo; H. Amii. Aromatic trifluoromethylation catalytic in copper. Chemical Communications. 2009, s. 1909–1911.
- ↑ T. Knauber; F. Arikan; G.-V. Roschenthaler; L. J. Gooßen. Copper-catalyzed trifluoromethylation of aryl iodides with potassium (trifluoromethyl) trimethoxyborate. Chemistry: A European Journal. 2011, s. 2689–2697. PMID 21274956.
- ↑ L. Chu; F.-L. Qing. Copper-mediated oxidative trifluoromethylation of boronic acids. Organic Letters. 2010, s. 5060–5063. PMID 20923196.
- ↑ Todd D. Senecal; Andrew T. Parsons; Stephen L. Buchwald. Room Temperature Aryl Trifluoromethylation via Copper-Mediated Oxidative Cross-Coupling. The Journal of Organic Chemistry. 18. 2. 2011, s. 1174–1176. PMID 21235259.
- ↑ Cheng-Pan Cheng; Pan Zhang; Ling Wang; Chun-Tao Prof; Yun Chen; Tao Zhang; Cheng Gu. Copper-mediated trifluoromethylation of heteroaromatic compounds by trifluoromethyl sulfonium salts. Angewandte Chemie International Edition. 2011, s. 1896–1900.
- ↑ H. Morimoto; T. Tsubogo; N. D. Litvinas; J. F. Hartwig. A broadly applicable copper reagent for trifluoromethylations and perfluoroalkylations of aryl iodides and bromides. Angewandte Chemie International Edition. 2011, s. 3793–3798.
- ↑ E. J. Cho; T. D. Senecal; T. Kinzel; Y. Zhang; D. A. Watson; S. L. Buchwald. The Palladium-Catalyzed Trifluoromethylation of Aryl Chlorides. Angewandte Chemie International Edition. 24. 6. 2010, s. 1679–1681. Bibcode 2010Sci...328.1679C.
- ↑ Jun-An Ma; Dominique Cahard. Strategies for nucleophilic, electrophilic, and radical trifluoromethylations. Journal of Fluorine Chemistry. 2007, s. 975–996.
- ↑ Claude P. Andrieux; Laurence Gelis; Jean-Michel Saveant. Unusual reactions resulting from the addition on olefins of trifluoromethyl radicals obtained from dissociative electron transfer between electrochemically generated aromatic anion radicals and trifluoromethyl bromide. Tetrahedron Letters. 1989, s. 4961–4964.
- ↑ Kenji Uneyama; Masatomi Kanai; Kouichi Kitagawa. Generation of perfluoroalkyl radicals at low temperature by tellurolate mediated electron transfer. Tetrahedron Letters. 1991, s. 375–378.
- ↑ Gary H. Rasmusson; Ronald D. Brown; Glen E. Arth. Photocatalyzed reaction of trifluoromethyl iodide with steroidal dienones. The Journal of Organic Chemistry. 1975, s. 672–675.
- ↑ Hsuan-Yin Lan-Hargest; John D. Elliott; Drake S. Eggleston; Brian W. Metcalf. The photochemical rearrangement of a steroidal dienol triflate. Tetrahedron Letters. 1987, s. 6557–6560.
- ↑ a b Katsukiyo Miura; Yoshihiro Takeyama; Koichiro Oshima; Kiitiro Utimoto. Triethylborane Induced Perfluoroalkylation of Silyl Enol Ethers and Ketene Silyl Acetals with Perfluoroalkyl Iodides. Bulletin of the Chemical Society of Japan. 1991, s. 1542–1553.
- ↑ Katsukiyo Miura; Masahiko Taniguchi; Kyoko Nozaki; Koichiro Oshima; Kiitiro Utimoto. Triethylborane Induced Perfluoroalkylation of Silyl Enol Ethers and Ketene Silyl Acetals with Perfluoroalkyl Iodides. Tetrahedron Letters. 1990, s. 6391–6394.
- ↑ Armido Studer. A "Renaissance" in Radical Trifluoromethylation. Angewandte Chemie International Edition. 3. 9. 2012, s. 8950–8958. PMID 22890985.
- ↑ R. N. Haszeldine. 603. The reactions of fluorocarbon radicals. Part I. The reaction of iodotrifluoromethane with ethylene and tetrafluoroethylene. Journal of the Chemical Society. 1949, s. 2856.
- ↑ a b Bernard R.Langlois; Thierry Billard; Solveig Roussel. Nucleophilic trifluoromethylation. Journal of Fluorine Chemistry. 2005, s. 173–179.
- ↑ G. K. Surya Prakash; Fang Wang; Zhe Zhang; Ralf Haiges; Martin Rahm; Karl O. Christe; Thomas Mathew. Long-Lived Trifluoromethanide Anion: A Key Intermediate in Nucleophilic Trifluoromethylations. Angewandte Chemie International Edition. 2014, s. 11575–11578. PMID 25146595.
- ↑ Tatsuya Shono; Manabu Ishifune; Toshio Okada; Shigenori Kashimura. Electroorganic chemistry. 130. A novel trifluoromethylation of aldehydes and ketones promoted by an electrogenerated base. The Journal of Organic Chemistry. 1991, s. 2–4.
- ↑ Rachid Barhdadi; Michel Troupel; Jacques Périchon. Coupling of fluoroform with aldehydes using an electrogenerated base. Chemical Communications. 1998, s. 1251–1252.
- ↑ a b Sylvie Large; Nicolas Roques; Bernard R. Langlois. Nucleophilic Trifluoromethylation of Carbonyl Compounds and Disulfides with Trifluoromethane and Silicon-Containing Bases. The Journal of Organic Chemistry. 2000, s. 8848–8856.
- ↑ Xiang-Shu Fei; Wei-Sheng Tian; Kai Ding; Yun Wang; Chen Qing-Yun. NEW, CONVENIENT ROUTE FOR TRIFLUOROMETHYLATION OF STEROIDAL MOLECULES. Organic Syntheses. 2010, s. 126.
- ↑ N. Shibata; A. Matsnev; D. Cahard. Shelf-stable electrophilic trifluoromethylating reagents: A brief historical perspective. Beilstein Journal of Organic Chemistry. 2010.
- ↑ T. Umemoto. Electrophilic Perfluoroalkylating Agents. Chemical Reviews. 1996, s. 1757–1778. PMID 11848810.
- ↑ S. N. Barata-Vallejo; B. Lantaño; A. Postigo. Recent Advances in Trifluoromethylation Reactions with Electrophilic Trifluoromethylating Reagents. Chemistry: A European Journal. 2014, s. 16806–16829.
- ↑ Yagupolskii, L. M.; Kondratenko, N. V.; Timofeeva, G. N. J. Org. Chem. USSR 1984, 20, 103–106;
- ↑ U. Teruo; I. Sumi. Power-variable trifluoromethylating agents, (trifluoromethyl)dibenzothio- and -selenophenium salt system. Tetrahedron Letters. 1990, s. 3579–3582.
- ↑ T. Umemoto; S. Ishihara. Power-variable electrophilic trifluoromethylating agents. S-, Se-, and Te-(trifluoromethyl)dibenzothio-, -seleno-, and -tellurophenium salt system. Journal of the American Chemical Society. 1993, s. 2156–2164.
- ↑ P. Eisenberger; S. Gischig; A. Togni. Novel 10-I-3 Hypervalent Iodine-Based Compounds for Electrophilic Trifluoromethylation. Chemistry: A European Journal. 2006, s. 2579–2586.
- ↑ I. Kieltsch; P. Eisenberger; A. Togni. Mild Electrophilic Trifluoromethylation of Carbon- and Sulfur-Centered Nucleophiles by a Hypervalent Iodine(III)–CF3 Reagent. Angewandte Chemie International Edition. 2007, s. 754–757. PMID 17154193.
- ↑ P. Eisenberger; I. Kieltsch; N. Armanino; A. Togni. Mild electrophilic trifluoromethylation of secondary and primary aryl- and alkylphosphines using hypervalent iodine(iii)–CF3 reagents. Chemical Communications. 2008, s. 1575.
- ↑ K. Stanek; R. Koller; A. Togni. Reactivity of a 10-I-3 Hypervalent Iodine Trifluoromethylation Reagent with Phenols. The Journal of Organic Chemistry. 2008, s. 7678–7685. PMID 18771328.
- ↑ a b P. Eisenberger. Preparation of a Trifluoromethyl Transfer Agent: 1-Trifluoromethyl-1,3-Dihydro-3,3-Dimethyl-1,2-Benziodoxole. Organic Syntheses. 2011, s. 168.
- ↑ A. T. Parsons; S. L. Buchwald. Copper-Catalyzed Trifluoromethylation of Unactivated Olefins. Angewandte Chemie International Edition. 2011, s. 9120–9123. PMID 21919144.
- ↑ Z. He; T. Luo; M. Hu; Y. Cao; J. Hu. Copper-Catalyzed Di- and Trifluoromethylation of α,β-Unsaturated Carboxylic Acids: A Protocol for Vinylic Fluoroalkylations. Angewandte Chemie International Edition. 2012, s. 3944–3947.
- ↑ Jun-An Ma; Dominique Cahard. Asymmetric Fluorination, Trifluoromethylation, and Perfluoroalkylation Reactions. Chemical Reviews. 2004, s. 6119–6146.
- ↑ Jin-Hong Lin; Ji-Chang Xiao. Recent advances in asymmetric fluorination and fluoroalkylation reactions via organocatalysis. Tetrahedron Letters. 2014, s. 6147–6155.
- ↑ Jerry W. Skiles; Victor Fuchs; Clara Miao; Ronald Sorcek; Karl G. Grozinger; Scott C. Mauldin; Jana Vitous. Inhibition of human leukocyte elastase (HLE) by N-substituted peptidyl trifluoromethyl ketones. Journal of Medicinal Chemistry. 1992, s. 641–662.
- ↑ Romesh C. Bansal; Barbara Dean; Sen-itiroh Hakomori; Tatsushi Toyokuni. Synthesis of trifluoromethyl analogue of L-fucose and 6-deoxy-D-altrose. Journal of the Chemical Society, Chemical Communications. 1991, s. 796.
- ↑ a b Katsuhiko Iseki; Takabumi Nagai; Yoshiro Kobayashi. Asymmetric trifluoromethylation of aldehydes and ketones with trifluoromethyltrimethylsilane catalyzed by chiral quaternary ammonium fluorides. Tetrahedron Letters. 1994, s. 3137–3138.
- ↑ a b Stéphane Caron; Nga Do; Patrice Arpin; Alexandre Larivée. Enantioselective Addition of a Trifluoromethyl Anion to Aryl Ketones and Aldehydes. Synthesis. 2003, s. 1693–1698.
- ↑ Teruo Umemoto; Kenji Adachi. New Method for Trifluoromethylation of Enolate Anions and Applications to Regio-, Diastereo- and Enantioselective Trifluoromethylation. The Journal of Organic Chemistry. 1994, s. 5692–5699.
- ↑ David A. Nagib; Mark E. Scott; David W. C. MacMillan. Enantioselective α-Trifluoromethylation of Aldehydes via Photoredox Organocatalysis. Journal of the American Chemical Society. 2009, s. 10875–10877. PMID 19722670.
- ↑ Anna E. Allen; David W. C. MacMillan. The Productive Merger of Iodonium Salts and Organocatalysis: A Non-photolytic Approach to the Enantioselective α-Trifluoromethylation of Aldehydes. Journal of the American Chemical Society. 2010, s. 4986–4987. PMID 20297822.
- ↑ Qing-Hai Deng; Hubert Wadepohl; Lutz H. Gade. Highly Enantioselective Copper-Catalyzed Electrophilic Trifluoromethylation of β-Ketoesters. Journal of the American Chemical Society. 2012, s. 10769–10772. PMID 22693950.
- ↑ Aaron T. Herrmann; Lindsay L. Smith; Armen Zakarian. A Simple Method for Asymmetric Trifluoromethylation of-Acyl Oxazolidinones via Ru-Catalyzed Radical Addition to Zirconium Enolates. Journal of the American Chemical Society. 2012, s. 6976–6979. PMID 22486383.
Média použitá na této stránce
Autor: Dissolution, Licence: CC BY-SA 3.0
Asymmetic trifluorination Iseki 1994
Autor: Dissolution, Licence: CC BY-SA 3.0
Togni reagent synth of Ethyl (R)-2-amino-3-(trifluoromethylthio)propanoate hydrochloride
Autor: Dissolution, Licence: CC BY-SA 3.0
Aromatic trifluoromethylation Oishi 2009
Autor: Fluorinator, Licence: CC BY-SA 3.0
Trifluoromethylation of Arenes and Heteroarenes by Means of Photoredox Catalysis
Autor: Dissolution, Licence: CC BY-SA 3.0
Cyclohexanol trifluoromethylation
Autor: Dissolution, Licence: CC BY-SA 3.0
McLoughlin-Thrower reaction
Autor: Dissolution, Licence: CC BY-SA 3.0
3,3-Dimethyl-1-(trifluoromethyl)-1,2-benziodoxole
Autor: Dissolution, Licence: CC BY-SA 3.0
Trifluoromethylation methyl fluorosulfonyldifluoroacetate
Autor: Dissolution, Licence: CC BY-SA 3.0
Trifluoromethylation enones
Autor: Dissolution, Licence: CC BY-SA 3.0
Trifluoromethylation fluoroform folleas 1998
Autor: Dissolution, Licence: CC BY-SA 3.0
Asymmetic trifluorination Caron 2003
Autor: Dissolution, Licence: CC BY-SA 3.0
5-(Trifluoromethyl)dibenzothiophenium tetraborate
Autor: Dissolution, Licence: CC BY-SA 3.0
Trifluorination Baran Langlois reagent 2011
Autor: Dissolution, Licence: CC BY-SA 3.0
Aromatic trifluoromethylation Kitazume 1982
Autor: Dissolution, Licence: CC BY-SA 3.0
Trifluorododecanone synthesis 1991
Autor: Dissolution, Licence: CC BY-SA 3.0
5-(Trifluoromethyl)dibenzothiophenium trifluoromethanesulfonate