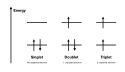
Tripletový stav

Tripletový stav je kvantový stav systému, jehož spin S je roven 1. Název pochází ze skutečnosti, že zde existují tři možné projekce spinu na danou osu mS = −1, 0, nebo +1.
Triplet vzniká v případech, kdy se spojí spiny dvou nespárovaných elektronů, kde má každý spin s = 1/2, za vzniku celkového spinu S = 1; tím se liší od (častějšího) případu, kdy jsou spiny elektronů uspořádány opačně a výsledný součet S je 0, tehdy jde o singletový stav. Za běžných podmínek je většina molekul singletová, protože jsou všechny jejich elektrony spárované; výjimkou je například molekulární kyslík.[1]
Za pokojové teploty O2 vytváří triplet, který může do chemických reakcí vstoupit pouze po přeměně na singlet, což jej činí kineticky stabilním, i když jde z termodynamického hlediska o jedno z nejsilnějších oxidačních činidel. Do singletového stavu se může dostat fotochemickou nebo tepelnou aktivací, a poté je i kineticky silným oxidantem.
Dvě částice se spinem 1/2
V systémech obsahujících dvě částice se spinem 1/2, například proton a elektron, ve vodíku v základním stavu, může mít každá z těchto částic spin orientovaný směrem nahoru nebo dolů, takže se celý systém může nacházet ve čtyřech různých stavech:
Přesněji:
kde a jsou spiny těchto částic a a jejich projekce na osu z. Protože se základní stavy částic se spinem 1/2, rozprostírají v dvourozměrném prostoru, tak kombinace zabírají čtyři rozměry.
S využitím těchto parametrů lze spočítat celkový spin a jeho projekci na definovanou osu pomocí pravidel pro sčítání momentů hybnosti v kvantové mechanice pomocí Clebschových–Gordanových koeficientů.
Obecně platí:
po substituci ve čtyřech základních stavech
vyjdou možné hodnoty celkového spinu. Tři stavy mají celkový spinový moment hybnosti 1[2]
a jsou tak symetrickými triplety, čtvrtý vykazuje celkový spinový moment hybnosti 0
a je antisymetrickým singletem. Ve výsledku tak kombinace dvou částic se spinem 1/2 může vytvořit výsledný spin 1 v tripletovém nebo 0 v singletovém stavu.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Triplet state na anglické Wikipedii.
- ↑ Weston Thatcher Borden; Roald Hoffmann; Thijs Stuyver; Bo Chen. Dioxygen: What Makes This Triplet Diradical Kinetically Persistent?. Journal of the American Chemical Society. 2017, s. 9010–9018. DOI 10.1021/jacs.7b04232. PMID 28613073.
- ↑ John S. Townsend. A modern approach to quantum mechanics. New York: McGraw-Hill, 1992. Dostupné online. ISBN 0-07-065119-1. S. 149.
Literatura
- Griffiths, David J. Introduction to Quantum Mechanics. 2nd. vyd. [s.l.]: Prentice Hall, 2004. ISBN 978-0-13-111892-8. (anglicky)
- Shankar, R. Principles of Quantum Mechanics. 2nd. vyd. [s.l.]: Springer, 1994. ISBN 978-0-306-44790-7. Kapitola 14-Spin. (anglicky)
Související články
- Singletový stav
- Dubletový stav
- Diradikál
- Moment hybnosti
- Pauliho matice
- Spinové kvantové číslo
- Spin-1/2
- Spinový tenzor
- Spinor
Média použitá na této stránce
Autor: Llightex, Licence: CC BY-SA 4.0
Explains the different kinds of spin multiplicity; the difference between singlet, doublet, and triplet states.