Tuberkulóza
| Tuberkulóza | |
|---|---|
 Rentgenový snímek plíce člověka s tuberkulózou | |
| Klasifikace | |
| MKN-10 | A15–A19 |
| MeSH | D014376 |
| Statistické údaje – obě pohlaví[1] | |
| Prevalence | 164 na 100 000 za rok |
| Incidence | 140 na 100 000 za rok |
| Mortalita | 19 na 100 000 za rok |
| Klinický obraz | |
| Postižený systém | nejčastěji plíce |
| Minimální inkubační doba | 3 týden |
| Maximální inkubační doba | 8 týden |
| Některá data mohou pocházet z datové položky. | |
Tuberkulóza (z lat. tuberculum – hrbolek, nádorek), též TBC, dříve souchotiny či úbytě (oubytě),[2] je infekční onemocnění způsobené bakteriemi ze skupiny Mycobacterium tuberculosis s nejvýznamnějším zástupcem M. tuberculosis.[3] Nemoc napadá nejen člověka, ale i zvířata.[4] Tuberkulóza většinou napadá plíce, ale může postihnout i jiné části těla. Šíří se kapénkovou infekcí, to znamená vzduchem, když osoba s aktivní formou tuberkulózy kašle, kýchá nebo jiným způsobem rozšiřuje své sliny vzduchem.[5] Většina infekcí je asymptomatická, latentní; zhruba jedno z deseti onemocnění přejde v aktivní tuberkulózu, která, když se neléčí, způsobuje úmrtí ve více než 50 % případů. Tuberkulózou se zabývá medicínský obor ftizeologie.[6]
Nejtypičtějším příznakem je chronický kašel s krvavým sputem – vykašlávání nebo chrlení krve (hemoptoe nebo také hemoptýza), horečka (Febris), noční pocení a ztráta tělesné hmotnosti. Infekce dalších orgánů způsobuje velkou škálu symptomů. Diagnóza se provádí mikrobiologickým vyšetřením sputa či odebraných vzorků tkáně, tuberkulinovým testem, pomocí radiologie (nejčastěji rentgenem hrudi) nebo krevními testy. Léčba je náročná a vyžaduje dlouhodobé užívání různých antibiotik. Vzrůstajícím problémem při léčbě je antibiotická rezistence některých druhů tuberkulózy. Prevence spočívá ve screeningu a očkování, převážně bacilem Calmettovým-Guérinovým (BCG) – očkování proti tuberkulóze se označuje jako kalmetizace.
Předpokládá se, že třetina světové populace je infikována bakterií M. tuberculosis[1][7] a zhruba každou sekundu je infikován nový člověk.[1] Procento celosvětové populace, které každý rok onemocní tuberkulózou, zůstává stejné nebo klesá, ale v důsledku růstu populace se počet nakažených zvyšuje.[1] V roce 2007 bylo odhadováno na 13,7 milionů chronických aktivních případů, 9,3 milionů nových případů a 1,8 milionů úmrtí, a to většinou v rozvojových zemích.[8] Ve světě není tuberkulóza rozšířena rovnoměrně – v mnoha asijských a afrických zemích je jí nakaženo až 80 % obyvatel, kdežto ve Spojených státech jen 5–10 %.[3] V Česku bylo v roce 2015 hlášeno 518 onemocnění tuberkulózou, tj. 4,9 případu na 100 000 obyvatel,[9] v roce 2009 to bylo 710 případů, tj. 6,8 na 100 tisíc obyvatel.[10]
Terminologie
Dříve se tuberkulóze říkalo souchotiny, úbytě nebo ftíza (což je řecký výraz pro úbytek), protože se zdálo, že lidi konzumuje zevnitř. Dalšími názvy jsou např. bílý mor, protože nemocní jsou výrazně bledí; nebo královo zlo, protože se věřilo, že králův dotyk souchotiny vyléčí. Krtice[11] je tuberkulóza napadající lymfatický systém, tuberkulóza okruží napadá břicho, lupus vulgaris napadá kůži a Pottova nemoc je zánět páteře a obratlů.[12][13]
Miliární tuberkulóza vzniká rozsevem mykobakterií přes oběhovou soustavu.[12][14] Bakterii M. tuberculosis se někdy říká Kochův bacil po jejím objeviteli Robertu Kochovi.[15]
Inkubační doba
Inkubační doba je 6 až 8 týdnů.
Historie

Průkaz a rozšíření
Tuberkulóza se u lidí vyskytuje už od pravěku. Genetická analýza indikuje stáří 40 tisíc let.[16] Nejstarší jednoznačný nález Mycobacterium tuberculosis pochází z pozůstatků bizona starého zhruba 18 000 let.[17] Není známo, jestli se tuberkulóza vyvinula u dobytka a pak se přenesla na lidi (zoonóza) nebo jestli se odpojila od společného předka infikujícího jiné druhy.[18] Spíše půjde o původní onemocnění člověka a jeho výskyt možná způsobuje používání ohně.[19] M. tuberculosis je považována za nejstarší druh tuberkulózních bakterií, z kterého se pak odpojila linie bakterií M. africanum, M. microti, M. pinnipedii, M. caprae a M. bovis. M. bovis je z těchto druhů považována za nejstarší.[20]
Kosterní pozůstatky z neolitické osady ve východním středomoří ukazují, že někteří lidé z období 7000 let př. n. l. měli tuberkulózu[21] a známky tuberkulózy se našly i v mumiích z období 3000–2400 let př. n. l.[22] Řecký výraz pro tuberkulózu je phthisis (česky ftíza); okolo roku 460 př. n. l určil Hippokratés ftízu jako nejrozšířenější onemocnění té doby, které zahrnuje vykašlávání krve a horečku a které je téměř vždy smrtelné.[23] V Jižní Americe pochází první důkazy tuberkulózy od kultury Paracas (zhruba 750 př. n. l.–100 n. l.).[24][25] Suzanne Austin Alchonová napsala, že „kosterní pozůstatky z pravěké Severní Ameriky naznačují, že tuberkulóza byla tak častá, že ‚prakticky každý člen těchto pravěkých společností byl vystaven tuberkulóze.‘“[26]
V 19. století patřila tuberkulóza mezi nejčastější příčiny úmrtí. Např. v Praze v dubnu 1862 z 527 zemřelých byla příčinou tuberkulóza u 155 z nich. Na sešlost věkem, vysílení a přirozenou slabost, což byla druhá nejčastější příčina, zemřelo ve stejném období jen 85 Pražanů.[27]
Výzkum a léčba

Ve starověku se léčba soustředila na stravu nemocných. Plinius starší popsal několik metod ve své knize Historia naturalis: „vlčí játra ponořená v řídkém víně, sádlo prasete krmeného trávou nebo kůže oslice ponořená ve vývaru“.[28] Avicenna psal o tuberkulóze ve své knize Kánon medicíny z počátku 11. století. Po Řecích převzal myšlenku, že onemocnění způsobuje znečištění vzduchu (teorie miasmat).[29]
I když v roce 1689 Richard Morton objevil, že plicní tuberkulóza je spojena s nádory („tuberkly“),[30][31] nebyla tuberkulóza až do 20. let 19. století kvůli rozmanitosti symptomů označena za jedno onemocnění. Jako „tuberkulózu“ ji pojmenoval v roce 1839 Johann Lukas Schönlein.[30] Mezi lety 1838–1845 se John Croghan, majitel Mamutí jeskyně, snažil vyléčit několik pacientů stálou teplotou a čistotou vzduchu v této jeskyni; všichni nemocní do roka zemřeli.[32] První sanatorium pro pacienty nakažené tuberkulózou otevřel v roce 1854 Hermann Brehmer v Görbersdorfu v Německu (dnešní Sokołowsko v Polsku).[33]
Bacil způsobující tuberkulózu, Mycobacterium tuberculosis, objevil a popsal 24. března 1882 Robert Koch, který za tento objev v roce 1905 získal Nobelovu cenu za fyziologii a lékařství.[34] Koch nevěřil, že dobytčí a lidská tuberkulóza jsou podobné, což opozdilo objev, že zdrojem infekce je mléko. Tento zdroj byl později odstraněn pasterizací. Koch v roce 1890 prohlásil, že lékem proti tuberkulóze je glycerolový extrakt bacilu tuberkulózy, a nazval ho „tuberkulin“. Léčba touto látkou byla neúspěšná, ale později se ujala při diagnóze tuberkulózy.[35]
Prvního úspěchu s očkováním proti tuberkulóze dosáhli Albert Calmette a Camille Guérin, když v roce 1906 vynalezli bacil Calmettův-Guérinův (BCG). Vakcína BCG byla na lidech poprvé použita v roce 1921 ve Francii,[36] ale v USA, Spojeném království a Německu byla přijata až po druhé světové válce.[37]

Tuberkulóza byla v 19. a 20. století známa jako endemické onemocnění chudých venkovanů.[38] V roce 1815 zapříčinila jedno ze čtyř úmrtí v Anglii; v roce 1918 byla příčinou jednoho ze šesti úmrtí ve Francii. Ve 20. století způsobila celkově zhruba 100 milionů úmrtí lidí.[39] Poté, co se v 80. letech 19. století zjistilo, že je nakažlivá, byla tuberkulóza v Británii prohlášena za onemocnění podléhající hlášení; existovaly snahy o zákaz plivání na veřejných místech a infikovaní chudí lidé byli nuceni ke vstupu do sanatorií, která připomínala vězení; sanatoria pro střední a vyšší třídy poskytovala nepřetržitou lékařskou pomoc.[33] I v nejlepších sanatoriích umíralo 50 % nemocných do pěti let po vstupu (údaj z roku 1916).[33]
V Evropě úmrtí v následku tuberkulózy klesla z 500/100 000 obyvatel v roce 1850 na 50/100 000 obyvatel v roce 1950. Zlepšování zdravotnictví zapříčinilo úbytek tuberkulózy ještě před příchodem antibiotik. Tuberkulóza zůstala tak závažným onemocněním, že když byl v roce 1913 ve Spojeném království založen Medical Research Council, jeho počátečním zaměřením byl výzkum tuberkulózy.[40]
Účinná léčba tuberkulózy přišla až s vývojem streptomycinu. Ten 19. října 1943 poprvé izoloval Albert Schatz, student Selmana Abrahama Waksmana na Rutgers University. Waksman poté v roce 1952 za objev získal Nobelovu cenu za fyziologii a medicínu.[41] Do té doby byly jediným způsobem léčby sanatoria a chirurgické zákroky, jako např. bronchoskopie nebo iatrogenní pneumotorax. Chirurgické zákroky se ale ukázaly neefektivními.[42] Do procesu léčby byly znovu zahrnuty až s příchodem multirezistentní tuberkulózy. Při její léčbě se chirurgicky odstraňují infikované tkáně a snižuje se tak počet bakterií v plicích a zbývající bakterie jsou více vystaveny lékům kolujícím v krevním oběhu. Předpokládá se tedy, že se tím zvyšuje účinnost chemoterapie.[43]
Naděje na úplné vymýcení tuberkulózy byla napadena příchodem rezistentních typů v 80. letech 20. století. Např. ve Spojeném království se počet případů snížil ze 117 000 v roce 1913 na zhruba 5 000 v roce 1987, ale pak zase vzrostl na 6300 v roce 2000 a 7600 v roce 2005.[44]
Návrat tuberkulózy vyústil v oznámení Světové zdravotnické organizace (WHO) v roce 1993 o nouzovém stavu ohrožení tímto onemocněním.[45] Odhaduje se, že každým rokem celosvětově přibývá půl milionu nových případů onemocnění multirezistentní tuberkulózou (MDR-TB).[46] V roce 2010 byl po dvaceti letech objeven nový druh bakterie řadící se do Mycobacterium tuberculosis komplexu, M. mungi.[47]
Oběti tuberkulózy
Na tuberkulózu zemřel Josef II., Václav II., Karel Havlíček Borovský, Josef Kajetán Tyl, Frederyk Chopin, Molière, Friedrich Schiller, Anton Pavlovič Čechov a další.[48]
Původce

Hlavním původcem tuberkulózy, Mycobacterium tuberculosis (MTB), je malá aerobní tyčinkovitá bakterie. Vysoký obsah lipidů způsobuje mnoho z jejích výjimečných vlastností.[49] Dělí se každých 16–20 hodin, což je v porovnání s ostatními bakteriemi, které se většinou dělí za méně než hodinu, extrémně pomalé.[50] Protože MTB má buněčnou stěnu, ale ne dvojici vnější a vnitřní plazmatické membrány, je klasifikována jako grampozitivní bakterie. Během Gramova barvení se ale kvůli vysokému obsahu lipidů v buněčné stěně barví buď velmi málo nebo vůbec.[51] MTB je schopna odolat slabé dezinfekci a dokáže přežít několik týdnů v suchém stavu. V přírodě může růst pouze v buňkách hostitele, ale lze ji pěstovat in vitro.[52]

Pomocí barvících mikrobiologických metod lze M. tuberculosis detekovat ve sputu. Nejčastěji používanou metodou je Ziehl-Neelsenovo barvení, při kterém se M. tuberculosis zbarví červeně. K vizualizaci MTB lze využít i směs auramin-rhodamin a fluorescenční mikroskopii.
Do komplexu M. tuberculosis, což je skupina geneticky blízkých mykobakterií, které způsobují tuberkulózu, patří ještě M. bovis, M. africanum, M. canetti a M. microti.[53] M. africanum není hojně rozšířená, ale v některých částech Afriky patří mezi důležité původce tuberkulózy.[54][55] M. bovis byla v minulosti běžnou příčinou tuberkulózy lidí, ale zavedením metody pasterizace mléka se infekce tímto druhem téměř eliminovala.[3][56] M. canetti je výjimečná a vyskytuje se téměř výhradně v Africe, i když bylo zaznamenáno několik případů výskytu této bakterie u afrických emigrantů.[57] M. microti je nejčastěji pozorována u lidí s poškozenou imunitou, i když je možné, že prevalence tohoto patogenu byla podceněna.[58]
Dalšími známými zástupci z rodu Mycobacterium jsou M. leprae, komplex Mycobacterium avium a M. kansasii. Poslední dvě zmíněné patří do skupiny netuberkulózních mykobakterií (NTM), které sice nezpůsobují tuberkulózu ani lepru, ale způsobují plicní onemocnění podobná tuberkulóze.[59]
Epidemiologie
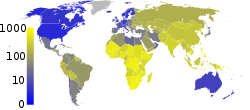
Bakterií M. tuberculosis je nakažena zhruba třetina světové populace a zhruba každou sekundu je infikován nový člověk.[1] Ne všechny tyto nákazy ale způsobují tuberkulózu a některé jsou asymptomatické.[63] Předpokládá se, že v roce 2007 bylo na světě zhruba 13,7 milionů lidí s aktivní formou tuberkulózy, z toho 9,3 milionů bylo nových případů. Ve stejném roce na tuberkulózu zemřelo 1,8 milionu lidí. Roční incidence se pohybovala mezi 363 případy na 100 000 lidí v Africe a 32 případy na 100 000 lidí v Americe.[8] Tuberkulóza způsobuje z infekčních onemocnění nejvíce úmrtí žen v reproduktivním věku a je jednou z hlavních příčin úmrtí u lidí s HIV/AIDS.[64]
Zvyšování počtu nákaz virem HIV a zanedbávání programů na kontrolu tuberkulózy vedly k nové vlně tohoto onemocnění.[65] Přispěl k tomu i nástup rezistentních typů tuberkulózy, kdy mezi lety 2000 a 2004 bylo 20 % případů rezistentních proti prvořadým antibiotikům a 2 % i proti druhořadým.[66] Rychlost výskytu nových onemocnění tuberkulózou se velmi liší, a to i u sousedních států, nejspíše kvůli rozdílům ve zdravotních systémech.[67]
V roce 2007 bylo státem s největší incidencí Svazijsko s 1200 případy na 100 000 lidí. Indie měla nejvíce nově nahlášených případů – 2 miliony.[8] Ve vyspělých zemích je tuberkulóza méně častá. Ve Spojeném království v roce 2007 činil národní průměr 15 nových případů na 100 000 lidí a největší míra incidence v západní Evropě byla 30/100 000 v Portugalsku a Španělsku. V Číně to pak bylo 98/100 000, v Brazílii 48/100 000 a ve Spojených státech 4/100 000.[61] V Kanadě se tuberkulóza vyskytuje v některých venkovských oblastech.[68] V Česku v roce 2007 činila incidence 9/100 000 s celkovým počtem 893 nakažených.
V 10. letech 21. století byl zaznamenán v Evropě nárůst počtu případů tuberkulózy, způsobený i migrací množství obyvatel ze zemí s velkým výskytem onemocnění. Ve Francii, Spojeném království, Německu a Španělsku bylo v roce 2014 zaznamenáno 75 % všech případů tuberkulózy právě u cizinců. I proto byly doporučeny u migrantů screeningové programy.[69]
Incidence tuberkulózy se mění s věkem. V Africe tuberkulóza postihuje převážně adolescenty a mladé lidi.[70] Tam, kde se incidence relativně rychle prudce snížila, např. ve Spojených státech, postihuje spíše staré lidi nebo lidi se ztrátou imunity.[3][71]
Rizikové faktory
Existuje několik známých faktorů, které zvyšují vnímavost na tuberkulózu: celosvětově nejvýznamnějším je HIV. Koinfekce virem HIV je problémem hlavně v subsaharské Africe, kde je nákaza tímto virem velmi častá.[72][73] Kouření 20 a více cigaret denně zvyšuje riziko nákazy tuberkulózou dvakrát až čtyřikrát.[74][75]
Na velikost rizika může mít vliv i strava. Např. mezi indickými imigranty v Londýně mají vegetariánští hinduisté zhruba 8,5krát větší šanci na rozvoj tuberkulózy než muslimové, kteří denně jedí maso a ryby.[76] I když to není důkaz příčinné souvislosti,[77] může být toto zvýšené riziko způsobeno nedostatkem stopových prvků: nejspíše železa, vitamínu B12 nebo vitamínu D.[76] Další výzkumy poskytly více důkazů o spojitosti nedostatku vitamínu D se zvýšeným rizikem onemocnění tuberkulózou.[78][79] V některých rozvojových zemích způsobuje velký nárůst rizika rozvoje aktivní tuberkulózy malnutrice, která poškozuje imunitní systém.[80][81] Spolu s přelidněním může být malnutrice jednou z hlavních příčin silné spojitosti mezi tuberkulózou a chudobou.[82][83]
Lidé se silikózou mají zhruba 30× větší šanci získat tuberkulózu.[84] Částice oxidu křemičitého dráždí dýchací soustavu a způsobují imunogenní reakce jako např. fagocytózu, které zase způsobují zanesení mízních cév.[85] Právě zhoršení funkce makrofágů způsobené částicemi oxidu křemičitého zvyšuje riziko rozvoje tuberkulózy.[86] Lidé s chronickým selháním ledvin a hemodialýzou mají také zvýšené riziko rozvoje tuberkulózy.[87]
Lidé s cukrovkou mají dvakrát až čtyřikrát větší riziko rozvoje aktivní tuberkulózy než lidé bez tohoto onemocnění, a toto riziko je vyšší u lidí s diabetes mellitus I. typu.[88] Mezi další klinické stavy, které jsou spojovány s aktivní tuberkulózou, patří např. gastrektomie, transplantace ledvin a srdce, karcinom hlavy a krku a další nádory (např. karcinom plic, lymfomy nebo leukemie).[84]
Se zvýšeným rizikem rozvoje tuberkulózy je také spojena nízká váha.[3][89] Index tělesné hmotnosti (BMI) menší než 18,5 zvyšuje riziko 2krát až 3krát. Zvýšení tělesné hmotnosti riziko snižuje.[90] Lidé s diabetes mellitus mají zvýšené riziko rozvoje tuberkulózy[91] a hůře reagují na léčbu, což může být způsobeno zhoršeným vstřebáváním léků.[92] Není to tak, že by diabetici měli zvýšené riziko zisku latentního stádia tuberkulózy, ale spíše je u nich vyšší pravděpodobnost přechodu z latentního do aktivního stádia.[93]
Mezi další faktory zvyšující riziko rozvoje tuberkulózy patří např. sdílení injekcí uživateli drog; dlouhodobá kortikosteroidní nebo jiná imunosupresivní terapie; selhání imunity (30–40 % lidí s AIDS má také tuberkulózu); Hodgkinova nemoc; střevní bypass; chronická porucha vstřebávání; nedostatek vitamínu D;[94] malnutrice; a alkoholismus.[3]
Výzkum dvojčat ve čtyřicátých letech 20. století naznačil, že vnímavost na tuberkulózu je dědičná. Jestliže jedno z dvojčat získalo tuberkulózu, druhé mělo vyšší pravděpodobnost získat toto onemocnění, pokud byla dvojčata jednovaječná.[95] Tato zjištění byla potvrzena novějšími výzkumy v Jihoafrické republice.[96][97][98] S vnímavostí na tuberkulózu je spojen polymorfismus genu IL12B.[99]
Některé léky, např. léky proti revmatoidní artritidě, které blokují funkci bílkoviny TNF-α (cytokinu vyvolávajícího záněty), zvyšují riziko aktivace latentní infekce kvůli důležitosti tohoto cytokinu při imunitní obraně proti tuberkulóze.[100]
Patogeneze
Když lidé s aktivní plicní tuberkulózou vykašlávají, kýchají, mluví nebo plivají, vylučují nakažlivé kapičky aerosolu o velikosti 0,5–5 µm v průměru. Jedním kýchnutím mohou vyloučit až 40 000 kapiček.[101] Každá z těchto kapiček může přenést tuberkulózu, protože infekční dávka tohoto onemocnění je velmi malá a infekci může způsobit i vdechnutí méně než deseti bakterií.[102][103]
Míra infekčnosti u lidí s dlouhodobým, častým a intenzivním kontaktem s tuberkulózou činí zhruba 22 %. Člověk s aktivní a neléčenou tuberkulózou průměrně nakazí 10–15 lidí za rok.[1] Dalšími rizikovými skupinami lidí jsou uživatelé drog injekčními stříkačkami, obyvatelé hojně obydlených oblastí, chudé vrstvy, vysokorizikové rasové nebo etnické menšiny, lidé se ztrátou imunity, uživatelé imunosupresivních léků a zdravotní pracovníci pracující s těmito rizikovými skupinami.[104]
Přenášet onemocnění mohou pouze lidé s aktivní – nelatentní – formou tuberkulózy.[3] Pravděpodobnost přenosu z osoby na osobu závisí na počtu infikovaných kapiček vyloučených nakaženým člověkem, efektivitě ventilace, době vystavení a virulenci konkrétní varianty M. tuberculosis.[89]
Řetězec přenosu lze přerušit izolací lidí nakažených aktivní formou tuberkulózy a zahájením protituberkulózní terapie. Po dvou týdnech léčení většinou lidé nakažení nerezistentním typem aktivní tuberkulózy přestávají být nakažlivými. Po nakažení člověka trvá tři až čtyři týdny, než se onemocnění může přenést na další lidi.[105]
Zhruba 90 % lidí nakažených bakterií Mycobacterium tuberculosis má asymptomatickou, latentní tuberkulózu.[3] U aktivní formy platí, že bez léčby je smrtelná z více než 50 %.[1]
Infekce začíná, když mykobakterie dosáhnou plicních sklípků, kde vniknou do endozomů alveolárních makrofágů a rozmnoží se.[3][106] Hlavní místo infekce v plicích se nazývá Ghonův komplex, který se většinou nachází ve vrchní části spodního laloku nebo ve spodní části vrchního laloku.[3] Bakterie pohltí dendritické buňky, které bakteriím znemožní replikaci, ale roznesou je do mízních uzlin. Dále jsou bakterie roznášeny přes krevní oběh do dalších tkání a orgánů a mohou vznikat druhotná poškození v plicích, okrajových mízních uzlinách, ledvinách, mozku a kostech.[3][107] Tuberkulóza může poškodit jakékoli části těla, ale jen výjimečně poškodí srdce, příčně pruhované svaly, slinivku břišní nebo štítnou žlázu.[108]
Tuberkulóza je zařazována mezi granulomatózní záněty. Mezi buňky, které granulomy vytvářejí, patří makrofágy, T-lymfocyty, B-lymfocyty a fibroblasty. Granulom zabraňuje šíření mykobakterií a poskytuje místo, kde se buňky imunitního systému snaží onemocnění zastavit. Bakterie v granulomu mohou přejít do nečinného stádia a to pak vyústí v latentní formu tuberkulózy. Tuberkulózní granulomy také vytvářejí mrtvé buňky (nekróza) ve středu nádoru. Tyto mrtvé buňky vzhledem připomínají sýr a této nekróze se proto říká kaseózní nekróza.[109]
Jestliže bakterie tuberkulózy vniknou do krevního oběhu z místa poškozené tkáně, šíří se tělem a zanechávají po sobě mnoho ložisek infekce, která vypadají jako malé bílé nádory. Tato rozšířená forma tuberkulózy je nejčastější u dětí a u starších lidí a nazývá se miliární tuberkulóza. Lidé s touto tuberkulózou bez léčby umírají téměř ve 100 % případů, s léčbou se pak míra fatality snižuje zhruba na 10 %.[110]
V mnoha případech se infekce rozšiřuje a zase ubývá. Poškození tkání a nekrózu vyvažují hojení a fibróza.[109] Nakažené tkáně jsou nahrazeny jizvami a dutiny jsou zaplněny bílým nekrotickým materiálem. Během aktivní formy tuberkulózy lze obsah některých těchto dutin vykašlat. Vykašlaný materiál obsahuje žijící bakterie, takže může přenášet infekci. Léčba vhodnými antibiotiky bakterie usmrcuje a umožňuje hojení. Po léčbě jsou nakažené oblasti nahrazeny zjizvenými tkáněmi.[109]
Neléčená tuberkulóza může způsobit lobární pneumonii.[111]
Klinické příznaky a symptomy

Poté, co onemocnění přejde do aktivního stadia, v 75 % případů zahrnuje infekci plic (plicní tuberkulóza). Mezi symptomy patří bolest hrudi, vykašlávání krve a kašel trvající déle než tři týdny, horečka, třesavka, noční pocení, ztráta chuti k jídlu, ztráta tělesné hmotnosti, pobledlost a únava.[113]
Ve zbylých 25 % případů se infekce přesune z plic a způsobuje jiné formy tuberkulózy, kterým se hromadně říká mimoplicní tuberkulóza.[114] To častěji probíhá u lidí s potlačenou imunitou a u malých dětí. Při tuberkulóze mízních uzlin (krtice) uzliny natékají a později z nich může začít vytékat tekutina. Tuberkulóza kostí a kloubů způsobuje bolest a oslabení kostí, které jsou pak náchylnější na zlomeniny. Může postihovat prakticky všechny kosti, např. obratle (Pottova nemoc) nebo čelistní kosti – z nich nejčastěji lícní kost, do které se šíří hematogenně (přenos krevní cestou) nebo per continuitatem (přestupem skrz tkáně), a projevy jsou charakteristické vznikem píštělí a vtažených jizev. Symptomy tuberkulózy trávicí soustavy jsou bolest břicha, průjem a krvácení z řitního otvoru. Urogenitální tuberkulóza způsobuje např. bolest při močení a krvavou moč a tuberkulóza centrální nervové soustavy způsobuje mimo jiné bolest hlavy, zamlžené vidění a záchvaty.[113] Dále existuje např. tuberkulóza kůže (lupus vulgaris nebo tuberculosis verrucosa cutis) způsobující pupínky, bradavice, puchýře nebo vředy[115] nebo tuberkulóza osrdečníku způsobující těžkosti při dýchání a bolest hrudi.[116] Obzvláště nebezpečnou formou tuberkulózy je miliární tuberkulóza, která napadá několik míst zároveň. Mimoplicní a plicní tuberkulóza mohou probíhat současně.[89]
Diagnostika

Rozhodujícím diagnostickým kritériem je průkaz tuberkulózních bacilů (Mycobacterium tuberculosis) v klinickém vzorku (např. ve sputu nebo hnisu), a to buď kultivačně nebo mikroskopicky. Když ho z nějakého důvodu nelze získat, je diagnóza možná pomocí zobrazování (např. rentgenu), tuberkulinového testu, histopatologie[5] anebo pomocí Interferon Gamma Release Assay (IGRA), ale tyto metody jsou často neprůkazné.[5]
Celková diagnóza při podezření z tuberkulózy by měla obsahovat anamnézu, fyzické vyšetření, rentgen hrudi, mikrobiologický vzorek (např. sputum) a buněčnou kulturu. Může obsahovat i tuberkulinový test a sérologický test. Hlavním problémem diagnózy je kultivace tohoto pomalurostoucího organismu v laboratoři, která může trvat 4–12 týdnů.[89] Jako kultivační médium může sloužit krevní agar nebo Lowensteinovo-Jensenovo médium.[117]

V současné době bývá latentní forma infekce diagnostikována u neočkovaných lidí tuberkulinovým kožním testem, který způsobuje reakci na vzorek M. tuberculosis.[3] Ti, kteří už proti tuberkulóze očkováni byli, na tento test reagují mnohem citlivěji.[118] Tuberkulinový test má tu nevýhodu, že někdy může být negativním i za přítomnosti tuberkulózy, zvláště pokud má testovaný člověk komorbidní sarkoidózu, Hodgkinovu nemoc, malnutrici nebo dokonce aktivní formu tuberkulózy.[3] Novější testy pomocí interferonů gama (Interferon Gamma Release Assay – IGRA) některé z těchto problémů překonaly. Testy IGRA jsou krevní testy in vitro a jsou přesnější než kožní testy. dokážou odhalit uvolňování interferonu gama v reakci na mykobakteriální bílkoviny jako ESAT-6.[119] Testy nejsou ovlivněny předchozím očkováním ani netuberkulózními mykobakteriemi, takže vracejí méně nesprávných pozitivních výsledků.[120] Neexistují důkazy, že testy IGRA jsou citlivější než kožní testy.[121]
Některé nově vyvinuté testy jsou rychlejší a přesnější než výše zmíněné. Mezi ně patří i test pomocí polymerázové řetězové reakce, který slouží ke zjištění bakteriální DNA.[122] Jeden z těchto testů vrací výsledek do 100 minut a v současné době je nabízen 116 rozvojovým zemím se slevou zajištěnou WHO a nadací Billa a Melindy Gatesových.[123]
Prevence

K prevenci a kontrole tuberkulózy se přistupuje ve dvou úrovních. První spočívá v identifikaci osob s tuberkulózou a lidí, s kterými se stýkají, a jejich následná léčba. Druhou úrovní je očkování dětí. Není dostupná žádná vakcína, která by poskytovala spolehlivou ochranu pro dospělé osoby. V tropických oblastech ale jako částečná ochrana může fungovat vystavení netuberkulózním mykobakteriím.[124]
Světová zdravotnická organizace (WHO) vyhlásila v roce 1993 nouzový stav ohrožení tuberkulózou a Stop TBC Partnership vyvinulo Celosvětový plán pro zastavení tuberkulózy (Global Plan to Stop Tuberculosis), který měl za cíl zachránit 14 milionů životů mezi lety 2006 až 2015.[125]
Vakcíny
Mnoho zemí využívá jako součást programu pro kontrolu tuberkulózy očkování bacilem Calmettovým-Guérinovým (BCG), a to hlavně pro kojence. BCG je jedna z nejčastěji využívaných vakcín současnosti, ve státech s národními programy vakcinace přesahuje míra zastoupení této vakcíny 80 %.[126] Jedním ze států, který BCG ve velké míře neposkytuje, jsou Spojené státy, kde tuberkulóza není tak častým onemocněním.[127] BCG byl první vakcínou proti tuberkulóze. Od roku 1905 na něm v Pasteurově ústavu pracovali Albert Calmette a Camille Guérin a první testy na lidech provedli v roce 1921.[36] Úmrtí způsobená špatnými výrobními procesy ale vytvořila veřejný odpor k BCG a hromadné očkování tak bylo odloženo až na dobu po druhé světové válce.[37] Metaanalýza několika studií ukázala, že účinnost vakcín BCG proti některým formám TBC u dětí jako je tuberkulózní meningitida a miliární tuberkulóza je vyšší než 80 %. Naproti tomu, účinnost BCG vakcín proti plicní formě TBC u dospívajících a dospělých se pohybuje od 0 do 80 %. Příčina tak velkého rozptylu hlášených účinností ochrany před plicní formou není známa, ale předpokládá se, že svoji roli hrají rozdíly mezi jednotlivými kmeny používanými při očkování, různá expozice sledovaných populací mykobaktériím v životním prostředí a genetické a výživové rozdíly jednotlivých populací.[128] Očkování bylo v ČR povinné od roku 1953 do roku 2010.
V současné době existuje celosvětově více případů tuberkulózy než kdykoli v historii.[129] V Jihoafrické republice, státě s nejvyšší prevalencí tuberkulózy, je BCG očkováno každé dítě ve věku do tří let.[130] BCG má slabší účinky v oblastech, kde je malá prevalence mykobakterií.
V současnosti existují snahy o vývoj novějších vakcín na prevenci tuberkulózy. První rekombinantní vakcína proti tuberkulóze, Mtb72F, vešla v USA do fáze klinického testování v roce 2004.[131][132] Výzkum z roku 2005 ukázal, že DNA vakcína proti tuberkulóze podávaná s obvyklou chemoterapií může u myší urychlit mizení bakterií a ochránit proti opětovné nákaze v budoucnosti.[133] Další vakcína MVA85A je založena na geneticky modifikovaném viru vaccinia (který fungoval jako vakcína proti neštovicím).[134] Pro vývoj nových vakcín se používá mnoho různých strategií.[135] Některé z těchto vakcín lze podávat bez použití jehel, což je výhodné pro oblasti s častými případy AIDS.[136]
Pozitivní vedlejší účinky
Stimulace imunitního systému vakcinací BCG zřejmě představuje faktor, který snižuje riziko vzniku maligního melanomu. Pfahlberg a kol. publikovali v roce 2002 studii designovanou jako retrospektivní analýza případů a kontrol, ve které zjistili, že odds ratio je po očkování 0,44.[137] BCG kmeny se testují jako prostředek ke stimulaci buněčné odpovědi imunitního systému při terapii řady nádorů, v některých případech se dostalo užití této formy imunoterapie i do klinické praxe.[138]
Léčba
Léčba tuberkulózy spočívá v podávání antibiotik (antituberkulotik), které usmrcují bakterie. Kvůli neobvyklé struktuře a chemickému složení buněčné stěny mykobakterií, které snižují účinnost antibiotik, je ale léčba obtížná.[139][140][141] V současné době jsou za nejúčinnější považovány plně kontrolované krátkodobé režimy (DOTS – Directly Observed Treatment Short-Course).[142] Používají se 4 kategorie léčby, a to podle lokalizace, rozsahu onemocnění a bakteriologického nálezu.[142] První kategorii tvoří nová bakteriologicky ověřená onemocnění a klinicky závažné formy plicní a mimoplicní tuberkulózy, druhou recidivy, léčebné neúspěchy a přerušené léčby, třetí méně závažné formy neověřené plicní a mimoplicní tuberkulózy, a čtvrtou tvoří ostatní případy, tedy lidé, kteří jsou bakteriologicky pozitivní i po úspěšném dokončení léčby.[142][143] Na léčbu každé kategorie se používá jiný léčebný režim.
Dvěma nejpoužívanějšími antibiotiky jsou isoniazid a rifampicin. Na rozdíl od většiny ostatních bakteriálních infekcí vyžaduje tuberkulóza mnohem delší dobu léčby (mezi 6 a 24 měsíci).[89] Příčinou je pomalé dělení a vysoká koncentrace lipidů snižujících prostupnost buněčné stěny.[144] Před začátkem léčby je vhodné stanovit citlivost mykobakteriálního kmene k základním antituberkulotikům (izoniazid, streptomycin, rifampicin, etambutol a pyrazinamid).[142][145] Léčebný režim je obvykle rozdělen na dvě fáze: iniciační (běžně 2 měsíce a za hospitalizace) a pokračovací (většinou ambulantní), která následuje bezprostředně poté.[142] K léčbě latentní tuberkulózy většinou postačí používat jeden typ antibiotik, ale aktivní formu je vhodnější léčit kombinací různých druhů antibiotik, aby se u bakterie nevyvinula antibiotická rezistence.[143][146] Léčba lidí s latentní tuberkulózou probíhá kvůli prevenci přechodu do aktivního stádia.
Antibiotická rezistence
Existují dva druhy rezistentní tuberkulózy. Primární rezistence vzniká nakažením rezistentním typem tuberkulózy. Sekundární (získaná) rezistence vzniká při nevhodné léčbě nerezistentní tuberkulózy, např. při požívání nekvalitních léků nebo porušování předepsaného režimu dávkování.[146] To totiž umožňuje evolučně řízený zisk rezistence.[147] Rezistentní tuberkulóza je problémem mnoha rozvojových zemí, protože její léčba trvá déle a vyžaduje dražší léky. Multirezistentní tuberkulóza (MDR-TB) je rezistentní proti dvěma nejúčinnějším prvořadým lékům: rifampicinu a isoniazidu. Extenzivně rezistentní tuberkulóza (XDR-TB) je navíc rezistentní proti jakémukoli fluorochinolonu a minimálně jednomu ze tří druhořadých antibiotik (kanamicin, kapreomycin, amikacin).[148] Celkem asi 4 % případů tuberkulózy je multirezistentních, ale v některých oblastech, např. v zemích bývalého Východního bloku, se takové případy vyskytují až 6× častěji.[149] Příčinou je upadající kvalita léčby (pacienti jsou léčeni pouze jedním nebo dvěma léky). Asi 5 % případů multirezistentní tuberkulózy je extenzivně rezistentní. Úspěšnost léčby tohoto typu je pouze 30 %.[144]
Prognóza
Přechod od nákazy tuberkulózou k onemocnění nastává, když mykobakterie překonají imunitní systém a začnou se rozmnožovat. Při primární tuberkulóze – která tvoří 1–5 % případů – se tak stává krátce po nakažení.[3] Ve většině případů se ale vyvine latentní tuberkulóza, která nemá žádné symptomy.[3] Latentní tuberkulóza pak přejde v aktivní formu ve 2–23 % případů, a to často několik let po nákaze.[150] Riziko přechodu do aktivní formy se zvyšuje s imunosupresí, která může být způsobena např. infekcí HIV.[3]
Tuberkulóza u zvířat

Tuberkulózu skotu (bovinní tuberkulózu) způsobuje Mycobacterium bovis. Ve vyspělých zemích byla z větší části potlačena (např. Česká republika dokončila eradikaci v roce 1968)[151], ale v přírodnímu rezervoáru (kterým jsou např. kusuové na Novém Zélandu, jezevci ve Spojeném království nebo bizoni v Kanadě) je v přírodě eradikace obtížná.[152] Například incidence bovinní tuberkulózy ve Velké Británii v posledních letech stále roste i přes probíhající intenzivní eradikaci. Krom šíření nemoci jezevci je jedním z možných vysvětlení i infekce skotu motolicí jaterní (Fasciola hepatica).[153] Souvislost je dána tím, že infekce motolicí jaterní u testovaného zvířete může způsobit falešně negativní výsledek při tuberkulinovém testu. Motoličnatost takto může maskovat tuberkulózu při diagnostice.[154] V rozvojových zemích je bovinní tuberkulóza stále běžným onemocněním.[152] Po nakažení trvá většinou několik měsíců, než se bovinní tuberkulóza začne projevovat. Mezi symptomy patří např. vyhublost, horečka, slabost a nechuť k jídlu.[152]
Původcem ptačí tuberkulózy je M. avium subsp. avium.[155] U prasat způsobuje tuberkulózu M. avium subsp. hominissuis.[156] Zdrojem prasečí tuberkulózy je nejčastěji kontaminované vnější prostředí a volně žijící ptáci.[157]
Paratuberkulózu způsobuje M. avium subsp. paratuberculosis.[158] Paratuberkulóza patří k běžným onemocněním v zemích západní Evropy, v USA a v Kanadě a od devadesátých let 20. století se začala objevovat i v Česku.[159] Inkubační doba paratuberkulózy je mezi 6 měsíci a 15 lety.[158] Hlavním příznakem je chronické hubnutí, u 10 až 20 % zvířat se objevuje průjem nazelenalé barvy a vodnaté konzistence.[158]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Tuberculosis na anglické Wikipedii.
- ↑ a b c d e f g Tuberculosis Fact sheet N°104 [online]. Světová zdravotnická organizace, 2010-11 [cit. 2011-06-07]. Dostupné v archivu pořízeném z originálu dne 2011-01-07.
- ↑ tuberkulóza, chronické infekční onemocnění [online]. CoJeCo. Dostupné online.
- ↑ a b c d e f g h i j k l m n o p Kumar, V., Abbas, A. K., Fausto, N., Mitchell, R. N. Robbins Basic Pathology. 8. vyd. [s.l.]: Saunders Elsevier, 2007. ISBN 978-1-4160-2973-1. S. 516–522.
- ↑ OSEL.cz: Intenzivní chovatelství znamená více tuberkulózy
- ↑ a b c Konstantinos, A. Testing for tuberculosis. Australian Prescriber. 2010, roč. 33, čís. 1, s. 12–18. Dostupné v archivu pořízeném dne 04-08-2010.
- ↑ CoJeCo.cz [online]. 2000-03-14, rev. 2006-09-07 [cit. 2012-06-28]. Heslo ftizeologie. Dostupné online.
- ↑ Jasmer, R. M., Nahid, P., Hopewell, P. C. Clinical practice. Latent tuberculosis infection. The New England Journal of Medicine. 2002, roč. 347, čís. 23, s. 1860–6. Dostupné v archivu pořízeném dne 2011-02-24. doi:10.1056/NEJMcp021045. PMID 12466511., který cituje Dolin, P. J., Raviglione, M. C., Kochi, A. Global tuberculosis incidence and mortality during 1990–2000. Bulletin of the World Health Organization. 1994, roč. 72, čís. 2, s. 213–20. PMID 8205640.
- ↑ a b c Světová zdravotnická organizace. Global tuberculosis control: epidemiology, strategy, financing [online]. 2009 [cit. 2009-11-12]. Kapitola Epidemiology, s. 6–33. Dostupné online. ISBN 9789241563802.
- ↑ Základní přehled epidemiologické situace ve výskytu tuberkulózy v České republice v roce 2015 [online]. Ústav zdravotnických informací a statistiky ČR, 2017 [cit. 2017-05-13]. Dostupné online.
- ↑ Výskyt tuberkulózy v České republice v roce 2009 [online]. Ústav zdravotnických informací a statistiky ČR, 2010-07-09 [cit. 2011-07-03]. Dostupné v archivu pořízeném dne 2012-01-07.
- ↑ Skrofulóza (krtice): příčiny, příznaky, diagnostika a léčba. cs.medlicker.com [online]. [cit. 2023-06-02]. Dostupné online. (anglicky)
- ↑ a b Tuberculosis [online]. Encyclopædia Britannica [cit. 2008-07-10]. (11). Dostupné v archivu pořízeném dne 10-07-2008.
- ↑ Rudy's List of Archaic Medical Terms [online]. English Glossary of Archaic Medical Terms, Diseases and Causes of Death [cit. 2006-10-09]. Dostupné v archivu pořízeném dne 2007-07-09.
- ↑ Disseminated tuberculosis [online]. Medical Encyclopedia od National Institutes of Health [cit. 2006-10-09]. Dostupné online.
- ↑ Bhansali, S. K. Abdominal tuberculosis. Experiences with 300 cases. The American Journal of Gastroenterology. 1977, roč. 67, čís. 4, s. 324–37. PMID 879148.
- ↑ Origin, Spread and Demography of the Mycobacterium tuberculosis Complex
- ↑ Rothschild, B., Martin, L., Lev, G., Bercovier, H., Bar-Gal, G., Greenblatt, C., Donoghue, H., Spigelman, M., Brittain, D. Mycobacterium tuberculosis complex DNA from an extinct bison dated 17,000 years before the present. Clinical Infectious Diseases. 2001, roč. 33, čís. 3, s. 305–11. doi:10.1086/321886. PMID 11438894.
- ↑ Pearce-Duvet, J. The origin of human pathogens: evaluating the role of agriculture and domestic animals in the evolution of human disease. Biological Reviews of the Cambridge Philosophical Society. 2006, roč. 81, čís. 3, s. 369–82. doi:10.1017/S1464793106007020. PMID 16672105.
- ↑ Early controlled use of fire may have led to emergence of tuberculosis
- ↑ Ernst, J. D., Trevejo-Nuñez, G., Banaiee, N. Genomics and the evolution, pathogenesis, and diagnosis of tuberculosis. The Journal of Clinical Investigation. 2007, roč. 117, čís. 7, s. 1738–45. doi:10.1172/JCI31810. PMID 17607348.
- ↑ Hershkovitz, I. a kolektiv. Detection and Molecular Characterization of 9000-Year-Old Mycobacterium tuberculosis from a Neolithic Settlement in the Eastern Mediterranean. PLoS ONE. 2008, roč. 3, čís. 10, s. e3426. doi:10.1371/journal.pone.0003426. PMID 18923677.
- ↑ Zink, A., Sola, C., Reischl, U., Grabner, W., Rastogi, N., Wolf, H., Nerlich, A. Characterization of Mycobacterium tuberculosis complex DNAs from Egyptian mummies by spoligotyping. Journal of Clinical Microbiology. 2003, roč. 41, čís. 1, s. 359–67. doi:10.1128/JCM.41.1.359-367.2003. PMID 12517873.
- ↑ Hippokratés. Aforisms [online]. [cit. 2006-10-07]. Dostupné v archivu pořízeném z originálu.
- ↑ South America: Prehistoric Findings. Memorias do Instituto Oswaldo Cruz [online]. 2003-01 [cit. 2007-02-08]. Čís. 98. Dostupné online.
- ↑ Konomi, N., Lebwohl, E., Mowbray, K., Tattersall, I., Zhang, D. Detection of mycobacterial DNA in Andean mummies. Journal of Clinical Microbiology. 2002, roč. 40, čís. 12, s. 4738–40. doi:10.1128/JCM.40.12.4738-4740.2002. PMID 12454182.
- ↑ Alchon, S. A. A pest in the land: new world epidemics in a global perspective [online]. University of New Mexico Press, 2003. S. 54. Dostupné online. ISBN 0826328717.
- ↑ Kronika/V dubnu zemřelo v Praze…. Rodinná kronika. 6/1862, s. 74. Dostupné online.
- ↑ Pliny the Elder, Natural History, citováno v Lewis, N., Reinhold, M. Roman Civilization [online]. 1990-12. Dostupné online. ISBN 9780231071338.
- ↑ Byrne, J. P. Encyclopedia of Pestilence, Pandemics, and Plagues: A-M [online]. ABC-CLIO, 2008 [cit. 2011-07-02]. S. 33. Dostupné v archivu pořízeném dne 2013-06-17. ISBN 0313341028.
- ↑ a b Léon Charles Albert Calmette [online]. Who Named It? [cit. 2006-10-06]. Dostupné online.
- ↑ Trail, R. Richard Morton (1637–1698). Medical History. 1970, roč. 14, čís. 2, s. 166–74. PMID 4914685.
- ↑ Kentucky: Mammoth Cave long on history. CNN [online]. 2004-02-27 [cit. 2006-10-08]. Dostupné v archivu pořízeném z originálu.
- ↑ a b c McCarthy, O. R. The key to the sanatoria. Journal of the Royal Society of Medicine. 2001, roč. 94, čís. 8, s. 413–7. PMID 11461990.
- ↑ The Nobel Prize in Physiology or Medicine 1905 [online]. Nobelova nadace [cit. 2011-07-17]. Dostupné online.
- ↑ Waddington, K. To stamp out "so terrible a malady": bovine tuberculosis and tuberculin testing in Britain, 1890–1939. Medical History. 2004, roč. 48, čís. 1, s. 29–48. PMID 14968644.
- ↑ a b Bonah, C. The 'experimental stable' of the BCG vaccine: safety, efficacy, proof, and standards, 1921–1933. Studies in History and Philosophy of Biological and Biomedical Sciences. 2005, roč. 36, čís. 4, s. 696–721. doi:10.1016/j.shpsc.2005.09.003. PMID 16337557.
- ↑ a b Comstock, G. The International Tuberculosis Campaign: a pioneering venture in mass vaccination and research. Clinical Infectious Diseases. 1994, roč. 19, čís. 3, s. 528–40. doi:10.1093/clinids/19.3.528. PMID 7811874.
- ↑ Tuberculosis through history [online]. Encyclopædia Britannica, rev. 2009-03-26 [cit. 2011-07-14]. Dostupné online.
- ↑ Torrey, E. F., Yolken, R. H. Their bugs are worse than their bite. The Washington Post [online]. 2005-04-03 [cit. 2011-07-20]. Dostupné online.
- ↑ MRC's contribution to Tuberculosis research [online]. Medical Research Council [cit. 2007-07-02]. Dostupné v archivu pořízeném dne 2007-12-15.
- ↑ Mistiaen, V. M. Time, and the great healer. The Guardian [online]. 2002-11-02 [cit. 2011-07-12]. Dostupné online.
- ↑ Wolfart, W. Surgical treatment of tuberculosis and its modifications—collapse therapy and resection treatment and their present-day sequelae. Öffentlicher Gesundheitsdienst. 1990, roč. 52, čís. 8–9, s. 506–11. PMID 2146567.
- ↑ Lalloo, U., Naidoo, R., Ambaram, A. Recent advances in the medical and surgical treatment of multi-drug-resistant tuberculosis. Current Opinion in Pulmonary Medicine. 2006, roč. 12, čís. 3, s. 179–85. doi:10.1097/01.mcp.0000219266.27439.52. PMID 16582672.
- ↑ Tuberculosis — Respiratory and Non-respiratory Notifications, England and Wales, 1913–2005 [online]. Health Protection Agency Centre for Infections, 2007-03-21 [cit. 2007-08-01]. Dostupné online.
- ↑ Tuberculosis: A global emergency. World health forum [online]. 1993. Dostupné online. PMID 8185806.
- ↑ "Drug-resistant tuberculosis: World Health Organization launches global response plan 2007-2008. Euro surveillance : bulletin europeen sur les maladies transmissibles [online]. 2007. Dostupné online. PMID 17868565.
- ↑ M. tuberculosis Complex Pathogen | CDC EID [online]. Cdc.gov, 2010-07-29 [cit. 2010-11-07]. Dostupné v archivu pořízeném dne 2010-10-05.
- ↑ ČT1: Události 19. říjen
- ↑ Southwick, F. Infectious Diseases: A Clinical Short Course, 2nd ed.. [s.l.]: McGraw-Hill Medical Publishing Division, 2007-12-10. Dostupné online. ISBN 0071477225. Kapitola Chapter 4: Pulmonary Infections, s. 104.
- ↑ Cox, R. Quantitative relationships for specific growth rates and macromolecular compositions of Mycobacterium tuberculosis, Streptomyces coelicolor A3(2) and Escherichia coli B/r: an integrative theoretical approach. Microbiology. 2004, roč. 150, čís. Pt 5, s. 1413–26. Dostupné online. doi:10.1099/mic.0.26560-0. PMID 15133103.
- ↑ Madison, B. Application of stains in clinical microbiology. Biotechnic and Histochemistry. 2001, roč. 76, čís. 3, s. 119–25. doi:10.1080/714028138. PMID 11475314.
- ↑ Parish, T., Stoker, N. Mycobacteria: bugs and bugbears (two steps forward and one step back). Molecular Biotechnology. 1999, roč. 13, čís. 3, s. 191–200. doi:10.1385/MB:13:3:191. PMID 10934532.
- ↑ van Soolingen, D. a kolektiv. A novel pathogenic taxon of the Mycobacterium tuberculosis complex, Canetti: characterization of an exceptional isolate from Africa. International Journal of Systematic Bacteriology. 1997, roč. 47, čís. 4, s. 1236–45. doi:10.1099/00207713-47-4-1236. PMID 9336935.
- ↑ Niemann, S. a kolektiv. Mycobacterium africanum subtype II is associated with two distinct genotypes and is a major cause of human tuberculosis in Kampala, Uganda. Journal of Clinical Microbiology. 2002, roč. 40, čís. 9, s. 3398–405. doi:10.1128/JCM.40.9.3398-3405.2002. PMID 12202584.
- ↑ Niobe-Eyangoh, S.N. a kolektiv. Genetic biodiversity of Mycobacterium tuberculosis complex strains from persons with pulmonary tuberculosis in Cameroon. Journal of Clinical Microbiology. 2003, roč. 41, čís. 6, s. 2547–53. doi:10.1128/JCM.41.6.2547-2553.2003. PMID 12791879.
- ↑ Thoen, C., Lobue, P., de Kantor, I. The importance of Mycobacterium bovis as a zoonosis. Veterinary Microbiology. 2006, roč. 112, čís. 2–4, s. 339–45. doi:10.1016/j.vetmic.2005.11.047. PMID 16387455.
- ↑ Pfyffer, G. E., Auckenthaler, R., van Embden, J. D., van Soolingen, D. Mycobacterium canettii, the smooth variant of M. tuberculosis, isolated from a Swiss patient exposed in Africa. Emerging Infectious Diseases. 1998, roč. 4, čís. 4, s. 631–4. doi:10.3201/eid0404.980414. PMID 9866740.
- ↑ Niemann, S., Richter, E., Dalügge-Tamm, H., Schlesinger, H., Graupner, D., Königstein, B., Gurath, G., Greinert, U., Rüsch-Gerdes, S. Two cases of Mycobacterium microti derived tuberculosis in HIV-negative immunocompetent patients. Emerging Infectious Diseases. 2000, roč. 6, čís. 5, s. 539–42. doi:10.3201/eid0605.000516. PMID 10998387.
- ↑ Diagnosis and treatment of disease caused by nontuberculous mycobacteria. American Journal of Respiratory and Critical Care Medicine. 1997, roč. 156, čís. 2 Pt 2, s. S1–25. PMID 9279284.
- ↑ WHO Disease and injury country estimates [online]. Světová zdravotnická organizace, 2004 [cit. 2009-11-11]. Dostupné online.
- ↑ a b Světová zdravotnická organizace. Global tuberculosis control: epidemiology, strategy, financing [online]. 2009 [cit. 2009-11-14]. Kapitola The Stop TB Strategy, case reports, treatment outcomes and estimates of TB burden, s. 187–300. Dostupné v archivu pořízeném dne 2009-11-19. ISBN 9789241563802.
- ↑ WHO report 2008: Global tuberculosis control [online]. Světová zdravotnická organizace (WHO) [cit. 2009-04-13]. Dostupné online.
- ↑ Fact Sheets: The Difference Between Latent TB Infection and Active TB Disease [online]. Centers for Disease Control, 2010-07-01 [cit. 2011-06-11]. Dostupné online.
- ↑ London tuberculosis rates now at Third World proportions [online]. Stop TB Partnership, 2002-12-04 [cit. 2006-10-03]. Dostupné online.
- ↑ Iademarco, M. F., Castro, K.G. Epidemiology of tuberculosis. Seminars in respiratory infections. 2003, roč. 18, čís. 4, s. 225–40. doi:10.1053/S0882-0546(03)00074-4. PMID 14679472.
- ↑ Centers for Disease Control and Prevention (CDC). Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs—worldwide, 2000–2004. Morbidity and Mortality Weekly Report. 2006, roč. 55, čís. 11, s. 301–5. Dostupné online. PMID 16557213.
- ↑ Sobero, R., Peabody, J. Tuberculosis control in Bolivia, Chile, Colombia and Peru: why does incidence vary so much between neighbors?. The International Journal of Tuberculosis and Lung Disease. 2006, roč. 10, čís. 11, s. 1292–5. PMID 17131791.
- ↑ Rural outbreaks of Mycobacterium tuberculosis in a Canadian province. Abstr Intersci Conf Antimicrob Agents Chemother Intersci Conf Antimicrob Agents Chemother. 1998, roč. 38, s. 555. Dostupné v archivu pořízeném dne 2011-11-18. abstract no. L-27. Archivováno 18. 11. 2011 na Wayback Machine.
- ↑ Archivovaná kopie. www.szu.cz [online]. [cit. 2021-11-27]. Dostupné v archivu pořízeném z originálu dne 2021-11-27.
- ↑ Global Tuberculosis Control Report, 2006 [online]. Světová zdravotnická organizace (WHO) [cit. 2006-10-13]. Dostupné online.
- ↑ 2005 Surveillance Slide Set [online]. Centers for Disease Control and Prevention (CDC), 2006-09-12 [cit. 2006-10-13]. Dostupné online.
- ↑ Global tuberculosis control – surveillance, planning, financing WHO Report 2006 [online]. Světová zdravotnická organizace (WHO) [cit. 2006-10-13]. Dostupné online.
- ↑ Chaisson, R. E., Martinson, N. A. Tuberculosis in Africa—combating an HIV-driven crisis. The New England Journal of Medicine. 2008, roč. 358, čís. 11, s. 1089–1092. doi:10.1056/NEJMp0800809. PMID 18337598.
- ↑ Davies, P. D. O., Yew, W. W., Ganguly, D. a kolektiv. Smoking and tuberculosis: the epidemiological association and pathogenesis. Transactions of the Royal Society of Tropical Medicine and Hygiene. 2006, roč. 100, čís. 4, s. 291–8. doi:10.1016/j.trstmh.2005.06.034. PMID 16325875.
- ↑ Jha, P., Jacob, B., Gajalakshmi, V. a kolektiv. A nationally representative case–control study of smoking and death in India. The New England Journal of Medicine. 2008, roč. 358, čís. 11, s. 1137–1147. doi:10.1056/NEJMsa0707719. PMID 18272886.
- ↑ a b Strachan, D. P., Powell, K. J., Thaker, A., Millard, F. J., Maxwell, J. D. Vegetarian diet as a risk factor for tuberculosis in immigrant south London Asians. Thorax. 1995-02, roč. 50, čís. 2, s. 175–80. doi:10.1136/thx.50.2.175. PMID 7701458.
- ↑ Davis, L. Vegetarian diet and tuberculosis in immigrant Asians. Thorax. 1995, roč. 50, čís. 8, s. 915–6. doi:10.1136/thx.50.8.915-c. PMID 7570453.
- ↑ Ustianowski, A., Shaffer, R., Collin, S., Wilkinson, R. J., Davidson, R. N. Prevalence and associations of vitamin D deficiency in foreign-born persons with tuberculosis in London. The Journal of Infection. 2005, roč. 50, čís. 5, s. 432–7. doi:10.1016/j.jinf.2004.07.006. PMID 15907552.
- ↑ Nnoaham, K. E., Clarke, A. Low serum vitamin D levels and tuberculosis: a systematic review and meta-analysis. International Journal of Epidemiology. 2008, roč. 37, čís. 1, s. 113–9. doi:10.1093/ije/dym247. PMID 18245055.
- ↑ Schaible, U. E., Kaufmann, S. H. Malnutrition and infection: complex mechanisms and global impacts. PLoS Medicine. 2007, roč. 4, čís. 5, s. e115. doi:10.1371/journal.pmed.0040115. PMID 17472433.
- ↑ Lönnroth, K., Raviglione, M. Global epidemiology of tuberculosis: prospects for control. Seminars in Respiratory and Critical Care Medicine. 2008, roč. 29, čís. 5, s. 481–91. doi:10.1055/s-0028-1085700. PMID 18810682.
- ↑ Davies, P. D. The world-wide increase in tuberculosis: how demographic changes, HIV infection and increasing numbers in poverty are increasing tuberculosis. Annals of Medicine. 2003, roč. 35, čís. 4, s. 235–43. doi:10.1080/07853890310005713. PMID 12846265.
- ↑ Spence, D. P., Hotchkiss, J., Williams, C. S., Davies, P. D. Tuberculosis and poverty. BMJ (Clinical research ed.). 1993, roč. 307, čís. 6907, s. 759–61. doi:10.1136/bmj.307.6907.759. PMID 8219945.
- ↑ a b Targeted Tuberculin Testing and Treatment of Latent Tuberculosis Infection, Table 3 [online]. CDC, rev. 2001-02-05. Dostupné online.
- ↑ Lee, J. H. Tuberculosis And Silicosis. Canadian Medical Association Journal. 1948, roč. 58, čís. 4, s. 349–353. PMID 18916106.
- ↑ Silicosis: eMedicine Pulmonology [online]. Emedicine.medscape.com, 2008-04-16 [cit. 2010-11-07]. Dostupné online.
- ↑ Segall, L., Covic, A. Diagnosis of tuberculosis in dialysis patients: current strategy. Clinical Journal of the American Society of Nephrology. 2010, roč. 5, čís. 6, s. 1114–22. doi:10.2215/CJN.09231209. PMID 20413440.
- ↑ Jeon, C. Y., Murray, M. B. Diabetes mellitus increases the risk of active tuberculosis: a systematic review of 13 observational studies. PLoS Medicine. 2008, roč. 5, čís. 7, s. e152. doi:10.1371/journal.pmed.0050152. PMID 18630984.
- ↑ a b c d e Core Curriculum on Tuberculosis: What the Clinician Should Know [online]. Centers for Disease Control and Prevention (CDC), oddělení pro odstranění tuberkulózy, 2000, rev. 2003-08. Dostupné online.
- ↑ Arch Intern Med – Leung et al. 167 (12): 1297 Figure OI70054F1 [online]. Archinte.ama-assn.org [cit. 2010-04-13]. Dostupné v archivu pořízeném dne 2011-11-18.
- ↑ Restrepo, B. I. Convergence of the tuberculosis and diabetes epidemics: Renewal of old acquaintances. Clinical Infectious Diseases. 2007, roč. 45, čís. 4, s. 436–438. doi:10.1086/519939. PMID 17638190.
- ↑ Nijland, H. M. J. a kolektiv. Exposure to rifampicin is strongly reduced in patients with tuberculosis and type 2 diabetes. Clinical Infectious Diseases. 2006, roč. 43, čís. 7, s. 848–854. doi:10.1086/507543. PMID 16941365.
- ↑ Dooley, K. E., Chaisson, R. E. Tuberculosis and diabetes mellitus: convergence of two epidemics. The Lancet Infectious Diseases. 2009, roč. 9, čís. 12, s. 737–46. doi:10.1016/S1473-3099(09)70282-8. PMID 19926034.
- ↑ Nnoaham, K. E., Clarke, A. Low serum vitamin D levels and tuberculosis: a systematic review and meta-analysis. International Journal of Epidemiology. 2008, roč. 37, čís. 1, s. 113–19. doi:10.1093/ije/dym247. PMID 18245055.
- ↑ Kallmann, F. J., Reisner, D. Twin studies on the significance of genetic factors in tuberculosis. American Review of Tuberculosis. 1942, roč. 16, s. 593–617.
- ↑ Jepson, A. a kolektiv. Genetic regulation of acquired immune responses to antigens of Mycobacterium tuberculosis: a study of twins in West Africa. Infection and Immunity. 2001, roč. 69, čís. 6, s. 3989–94. doi:10.1128/IAI.69.6.3989-3994.2001. PMID 11349068.
- ↑ Sepulveda, R. L., Heiba, I. M., Navarrete, C., Elston, R. C., Gonzalez, B., Sorensen, R. U. Tuberculin reactivity after newborn BCG immunization in mono‐ and dizygotic twins. Tubercle and Lung Disease. 1994, roč. 75, čís. 2, s. 138–43. doi:10.1016/0962-8479(94)90043-4. PMID 8032047.
- ↑ Cobat, A. a kolektiv. High heritability of antimycobacterial immunity in an area of hyperendemicity for tuberculosis disease. Journal of Infectious Diseases. 2010, roč. 201, čís. 1, s. 15–19. doi:10.1086/648611. PMID 19938975.
- ↑ Tso, H. W., Lau, Y. L., Tam, C. M., Wong, H. S., Chiang, K. S. Associations between IL12B polymorphisms and tuberculosis in the Hong Kong Chinese population. Journal of Infectious Diseases. 2004, roč. 190, čís. 5, s. 913–9. doi:10.1086/422693. PMID 15295696.
- ↑ Mutlu, G., Mutlu, E., Bellmeyer, A., Rubinstein, I. Pulmonary adverse events of anti-tumor necrosis factor-alpha antibody therapy. American Journal of Medicine. 2006, roč. 119, čís. 8, s. 639–46. doi:10.1016/j.amjmed.2006.01.015. PMID 16887405.
- ↑ Cole, E., Cook, C. Characterization of infectious aerosols in health care facilities: an aid to effective engineering controls and preventive strategies. American Journal of Infection Control. 1998, roč. 26, čís. 4, s. 453–64. doi:10.1016/S0196-6553(98)70046-X. PMID 9721404.
- ↑ Nicas, M., Nazaroff, W. W., Hubbard, A. Toward understanding the risk of secondary airborne infection: emission of respirable pathogens. Journal of Occupational and Environmental Hygiene. 2005, roč. 2, čís. 3, s. 143–54. doi:10.1080/15459620590918466. PMID 15764538.
- ↑ Behr, M. A. a kolektiv. Transmission of Mycobacterium tuberculosis from patients smear-negative for acid-fast bacilli. Lancet. 1999, roč. 353, čís. 9151, s. 444–9. doi:10.1016/S0140-6736(98)03406-0. PMID 9989714.
- ↑ Griffith, D., Kerr, C. Tuberculosis: disease of the past, disease of the present. Journal of PeriAnesthesia Nursing. 1996, roč. 11, čís. 4, s. 240–5. doi:10.1016/S1089-9472(96)80023-2. PMID 8964016.
- ↑ Causes of Tuberculosis [online]. Klinika Mayo, 2006-12-21 [cit. 2007-10-19]. Dostupné online.
- ↑ Houben, E., Nguyen, L., Pieters, J. Interaction of pathogenic mycobacteria with the host immune system. Current Opinion in Microbiology. 2006, roč. 9, čís. 1, s. 76–85. doi:10.1016/j.mib.2005.12.014. PMID 16406837.
- ↑ Herrmann, J., Lagrange, P. Dendritic cells and Mycobacterium tuberculosis: which is the Trojan horse?. Pathologie Biologie. 2005, roč. 53, čís. 1, s. 35–40. doi:10.1016/j.patbio.2004.01.004. PMID 15620608.
- ↑ Agarwal, R., Malhotra, P., Awasthi, A., Kakkar, N., Gupta, D. Tuberculous dilated cardiomyopathy: an under-recognized entity?. BMC Infectious Diseases. 2005, roč. 5, čís. 1, s. 29. doi:10.1186/1471-2334-5-29. PMID 15857515.
- ↑ a b c Grosset, J. Mycobacterium tuberculosis in the extracellular compartment: an underestimated adversary. Antimicrobial Agents and Chemotherapy. 2003, roč. 47, čís. 3, s. 833–6. doi:10.1128/AAC.47.3.833-836.2003. PMID 12604509.
- ↑ Kim, J., Park, Y., Kim, Y., Kang, S., Shin, J., Park, I., Choi, B. Miliary tuberculosis and acute respiratory distress syndrome. The International Journal of Tuberculosis and Lung Disease. 2003, roč. 7, čís. 4, s. 359–64. PMID 12733492.
- ↑ Sambandamurth, V., Wang, X., Chen, B., Russell, R., Derrick, S., Collins, F., Morris, S., Jacobs, W. A pantothenate auxotroph of Mycobacterium tuberculosis is highly attenuated and protects mice against tuberculosis. Nature Medicine. 2002, roč. 8, čís. 10, s. 1171–74. doi:10.1038/nm765. PMID 12219086.
- ↑ Schiffman, G. Tuberculosis Symptoms [online]. eMedicineHealth, rev. 2009-05-15. Dostupné online.
- ↑ a b Tuberculosis (TB) Symptoms [online]. National Health Service (NHS) UK [cit. 2011-04-17]. Dostupné online.
- ↑ Golden, M. P., Vikram, H. R. Extrapulmonary tuberculosis: an overview. American Family Physician. 2005, roč. 72, čís. 9, s. 1761–8. PMID 16300038.
- ↑ Southall, H. Cutaneous Tuberculosis Symptoms [online]. eHow.com [cit. 2011-07-12]. Dostupné v archivu pořízeném dne 2011-05-03.
- ↑ Drape, R. Non-pulmonary Tuberculosis [online]. Patient.co.uk, rev. 2009-11-19 [cit. 2011-07-12]. Dostupné v archivu pořízeném dne 2010-12-02.
- ↑ Rapid culture of Mycobacterium tuberculosis on blood agar in resource limited setting. Danish Medical Bulletin [online]. 2009-11-04 [cit. 2011-07-13]. Dostupné v archivu pořízeném dne 2011-07-19.
- ↑ Rothel, J., Andersen, P. Diagnosis of latent Mycobacterium tuberculosis infection: is the demise of the Mantoux test imminent?. Expert Review of Anti-Infective Therapy.. 2005, roč. 3, čís. 6, s. 981–93. doi:10.1586/14787210.3.6.981. PMID 16307510.
- ↑ Nahid, P., Pai, M., Hopewell, P. Advances in the diagnosis and treatment of tuberculosis. Proceedings of the American Thoracic Society. 2006, roč. 3, čís. 1, s. 103–10. doi:10.1513/pats.200511-119JH. PMID 16493157.
- ↑ Pai, M., Zwerling, A., Menzies, D. Systematic Review: T-Cell-Based Assays for the Diagnosis of Latent Tuberculosis Infection: An Update. Annals of Internal Medicine. 2008, roč. 149, čís. 3, s. 1–9. PMID 18593687.
- ↑ Lalvani, A., Richeldi, L., Kunst, H. Interferon gamma assays for tuberculosis. The Lancet Infectious Diseases. 2005, roč. 5, čís. 6, s. 322–4; odpověď autora 325–7. doi:10.1016/S1473-3099(05)70118-3. PMID 15919613.
- ↑ Reddy, J. R., Kwang, J., Lechtenberg, K. F., Khan, N. C., Prasad, R. B., Chengappa, M. M. An immunochromatographic serological assay for the diagnosis of Mycobacterium tuberculosis. Comparative Immunology, Microbiology & Infectious Diseases. 2002, roč. 25, čís. 1, s. 21–7. doi:10.1016/S0147-9571(01)00016-9. PMID 11831744.
- ↑ WHO says Cepheid rapid test will transform TB care. Reuters. 2010-12-08. Dostupné online.
- ↑ Fine, P., Floyd, S., Stanford, J., Nkhosa, P., Kasunga, A., Chaguluka, S., Warndorff, D., Jenkins, P., Yates, M., Ponnighaus, J. Environmental mycobacteria in northern Malawi: implications for the epidemiology of tuberculosis and leprosy. Epidemiology and Infection. 2001, roč. 126, čís. 3, s. 379–87. doi:10.1017/S0950268801005532. PMID 11467795.
- ↑ The Global Plan to Stop TB [online]. Světová zdravotnická organizace, 2011 [cit. 2011-06-13]. Dostupné v archivu pořízeném dne 2011-06-12.
- ↑ BCG Vaccine. Weekly Epidemiological Record. 2004, čís. 4, s. 27–38. Dostupné online [cit. 2011-06-13].
- ↑ Vaccine and Immunizations: TB Vaccine (BCG) [online]. Centers for Disease Control and Prevention, 2011 [cit. 2011-06-13]. Dostupné v archivu pořízeném dne 2011-11-17.
- ↑ Liu, J., Tran, V., Leung, A. S., Alexander, D. S., Zhu, B. BCG vaccines: their mechanisms of attenuation and impact on safety and protective efficacy. Human Vaccines. 2009, roč. 5, čís. 2, s. 70–8. Dostupné online. PMID 19164935.
- ↑ Skeiky, Y. A., Sadoff, J. C. Advances in tuberculosis vaccine strategies. Nature Reviews Microbiology. 2006, roč. 4, čís. 6, s. 469–76. doi:10.1038/nrmicro1419. PMID 16710326.
- ↑ WHO/UNICEF Review of National Immunization Coverage 1980–2005: South Africa [online]. Světová zdravotnická organizace, 2006-08 [cit. 2207-06-08]. Dostupné v archivu pořízeném z originálu.
- ↑ National Institute of Allergy and Infectious Diseases: First U.S. Tuberculosis Vaccine Trial in 60 Years Begins, tisková zpráva, 2004-01-26, [cit. 2009-09-27], Dostupné on-line. Archivováno 24. 9. 2009 na Wayback Machine. Archivovaná kopie. www.nih.gov [online]. [cit. 2011-07-01]. Dostupné v archivu pořízeném z originálu dne 2009-09-24.
- ↑ Skeiky, Y. A., Alderson, M. R., Ovendale, P. J., Guderian, J. A., Brandt, L., Dillon, D. C., Campos-Neto, A., Lobet, Y., Dalemans, W. Differential immune responses and protective efficacy induced by components of a tuberculosis polyprotein vaccine, Mtb72F, delivered as naked DNA or recombinant protein. Journal of Immunology. 2004, roč. 172, čís. 12, s. 7618–28. PMID 15187142.
- ↑ Ha, S., Jeon, B., Youn, J., Kim, S., Cho, S., Sung, Y. Protective effect of DNA vaccine during chemotherapy on reactivation and reinfection of Mycobacterium tuberculosis. Gene Therapy. 2005, roč. 12, čís. 7, s. 634–8. doi:10.1038/sj.gt.3302465. PMID 15690060.
- ↑ Ibanga, H., Brookes, R., Hill, P., Owiafe, P., Fletcher, H., Lienhardt, C., Hill, A., Adegbola, R., McShane, H. Early clinical trials with a new tuberculosis vaccine, MVA85A, in tuberculosis-endemic countries: issues in study design. The Lancet Infectious Diseases. 2006, roč. 6, čís. 8, s. 522–8. doi:10.1016/S1473-3099(06)70552-7. PMID 16870530.
- ↑ Doherty, T. M., Andersen, P. Vaccines for Tuberculosis: Novel Concepts and Recent Progress. Clinical Microbiology Reviews. 2005, roč. 18, čís. 4, s. 687–702. doi:10.1128/CMR.18.4.687-702.2005. PMID 16223953.
- ↑ Dietrich, J., Andersen, C., Rappuoli, R., Doherty, T. M., Jensen, C. G., Andersen, P. Mucosal Administration of Ag85B-ESAT-6 Protects against Infection with Mycobacterium tuberculosis and Boosts Prior Bacillus Calmette-Guérin Immunity. Journal of Immunology. 2006, roč. 177, s. 6353–6360. Dostupné online [PDF, cit. 2009-03-01].
- ↑ PFAHLBERG, A.; KÖLMEL, K.F.; GRANGE, J.M., et al. Inverse association between melanoma and previous vaccinations against tuberculosis and smallpox: results of the FEBIM study. J Invest Dermatol. 2002, roč. 119, čís. 3, s. 570–5. Dostupné online. ISSN 0022-202X.
- ↑ DILLMAN, R.O. Cancer immunotherapy. Cancer Biother Radiopharm. 2011, roč. 26, čís. 1, s. 1–64. Dostupné online. ISSN 1557-8852.
- ↑ Migliore, D., Acharya, N. P. V., Jolles, P. Characterization of large quantities of glutamic acid in the walls of human virulent strains of mycobacteria. Comptes rendus hebdomadaires des séances de l'Académie des sciences. 1966, roč. 263, čís. 11, s. 846–8. PMID 4958543.
- ↑ Acharya, P. V., Goldman, D. S. Chemical composition of the cell wall of the H37Ra strain of Mycobacterium tuberculosis. Journal of Bacteriology. 1970, roč. 102, čís. 3, s. 733–9. PMID 4988039.
- ↑ Brennan, P. J., Nikaido, H. The envelope of mycobacteria. Annual Review of Biochemistry. 1995, roč. 64, s. 29–63. doi:10.1146/annurev.bi.64.070195.000333. PMID 7574484.
- ↑ a b c d e Ošťádal, B., Kos, S. Standard lékařské péče CLK001 LP [online]. 2002-10-29 [cit. 2011-07-15]. Dostupné v archivu pořízeném dne 2006-05-20.
- ↑ a b Potrepčiaková, S., Skřičková, J. Tuberkulóza. Practicus [online]. 2008-04 [cit. 2011-07-15]. Dostupné v archivu pořízeném dne 2012-01-11.
- ↑ a b Dalton, J. Antibiotic Resistance of Tuberculosis. The Dartmouth Undergraduate Journal of Science [online]. 2009-02-22 [cit. 2011-07-21]. Dostupné v archivu pořízeném dne 2012-04-19.
- ↑ Bártů, V. Tuberkulóza – infekční choroba v 21. století. Medicína pro praxi [online]. 2008 [cit. 2011-07-17]. Dostupné online.
- ↑ a b O'Brien, R. Drug-resistant tuberculosis: etiology, management and prevention. Seminars in Respiratory Infections. 1994, roč. 9, čís. 2, s. 104–12. PMID 7973169.
- ↑ Johnson, R., Streicher, E. M., Louw, G. E., Warren, R. M., van Helden, P. D., Victo, T. C. Drug Resistance in Mycobacterium tuberculosis [online]. [cit. 2011-07-21]. Dostupné v archivu pořízeném dne 2012-02-01.
- ↑ WHO Global Task Force outlines measures to combat XDR-TB worldwide [online]. Světová zdravotnická organizace, 2006-10-17. Dostupné online.
- ↑ Brown, D. Drug-resistant tuberculosis poses global risk, World Health Organization says. The Washington Post [online]. 2010-03-20. Dostupné online.
- ↑ Parrish, N., Dick, J., Bishai, W. Mechanisms of latency in Mycobacterium tuberculosis. Trends in Microbiology. 1998, roč. 6, čís. 3, s. 107–12. doi:10.1016/S0966-842X(98)01216-5. PMID 9582936.
- ↑ Pavlas, M. Z historie tlumení bovinní tuberkulózy u skotu v Československu [online]. 2008-12-18. Dostupné online.[nedostupný zdroj]
- ↑ a b c Bovine Tuberculosis [online]. The Center for Food Security and Public Health, 2007, rev. 2009-07-20. Dostupné online.
- ↑ Claridge, J., Diggle, P., McCann, C. M., Mulcahy, G., Flynn, R., McNair, J., Strain, S., Welsh, M., Baylis, M., Williams, D.J. Fasciola hepatica is associated with the failure to detect bovine tuberculosis in dairy cattle [online]. 2012-05-22. Dostupné online.
- ↑ Flynn RJ, Mannion C, Golden O, Hacariz O, Mulcahy G. Experimental Fasciola hepatica infection alters responses to tests used for diagnosis of bovine tuberculosis. Infection and Imunity. 2007, roč. 75, čís. 3, s. 1373–1381. Dostupné online.
- ↑ Vařejka, F., Mráz, O., Smola, J. Speciální veterinární mikrobiologie. Praha: SPN, 1989. 258 s.
- ↑ Sources of Infection: Mycobacterium Avium Infections in Pigs, Humans and Birds in Norway. Science Daily [online]. 2010-02-04 [cit. 2011-07-18]. Dostupné online.
- ↑ Pavlík, I. Tuberkulóza u prasat – nově se objevující rizika v České republice [online]. Výzkumný ústav veterinárního lékařství, 2009-08-31 [cit. 2255-01-04]. Dostupné online.
- ↑ a b c Pavlík, I. Paratuberkulóza [online]. Výzkumný ústav veterinárního lékařství, 2004 [cit. 2011-07-18]. Dostupné v archivu pořízeném dne 2011-04-07.
- ↑ Hátlová, P. Crohnovy choroby je u nás stále více. Na vině je možná mléko. Novinky.cz [online]. Borgis, 2010-05-19. Dostupné online.
Literatura
- Styblo, Karel & World Health Organization. Tuberculosis and Respiratory Infections Unit. (1985). Epidemiology of tuberculosis in children / by K. Styblo. World Health
Související články
- Abreografie
- Kalmetizace
- Karel Stýblo
- Ptačí tuberkulóza
- Tuberkulin
Externí odkazy
 Obrázky, zvuky či videa k tématu tuberkulóza na Wikimedia Commons
Obrázky, zvuky či videa k tématu tuberkulóza na Wikimedia Commons  Slovníkové heslo tuberkulóza ve Wikislovníku
Slovníkové heslo tuberkulóza ve Wikislovníku
- Česky
- Očkování proti tuberkulóze na Vakciny.net
- Kubín M.: Tuberkulóza – prevence a léčba. na Zdrav.cz
- Světu hrozí nová forma tuberkulózy
- Potrepčiaková S., Skřičková, J.: Tuberkulóza. Practicus 2008; 4: 24-29
- Bártů V.: Tuberkulóza – infekční choroba v 21. století. Med. Pro Praxi 2008; 5(6): 245-248
- Tuberkulóza dospělých na webu České pneumologické a ftizeologické společnosti při České lékařské společnosti Jana Evangelisty Purkyně
- Romantická choroba geniálních umělců či krásných dívek? Kulturní proměny jedné nemoci
- Anglicky
- Stop TB Partnership
- CDC – Tuberculosis
- HPA – Tuberculosis
- The Tuberculosis Coalition for Technical Assistance
- Tuberculosis na MedicineNet.com
- Tuberculosis 2007 – A Medical Textbook

Přečtěte si prosím pokyny pro využití článků o zdravotnictví.
Média použitá na této stránce
Star of life, blue version. Represents the Rod of Asclepius, with a snake around it, on a 6-branch star shaped as the cross of 3 thick 3:1 rectangles.
Design:
The logo is basically unicolor, most often a slate or medium blue, but this design uses a slightly lighter shade of blue for the outer outline of the cross, and the outlines of the rod and of the snake. The background is transparent (but the star includes a small inner plain white outline). This makes this image usable and visible on any background, including blue. The light shade of color for the outlines makes the form more visible at smaller resolutions, so that the image can easily be used as an icon.
This SVG file was manually created to specify alignments, to use only integers at the core 192x192 size, to get smooth curves on connection points (without any angle), to make a perfect logo centered in a exact square, to use a more precise geometry for the star and to use slate blue color with slightly lighter outlines on the cross, the rod and snake.
Finally, the SVG file is clean and contains no unnecessary XML elements or attributes, CSS styles or transforms that are usually added silently by common SVG editors (like Sodipodi or Inkscape) and that just pollute the final document, so it just needs the core SVG elements for the rendering. This is why its file size is so small.Autor: Roman Halouzka, Licence: CC BY-SA 3.0
avian tuberculosis (liver, spleen, intestines) - chicken - with dissection through the tubercules
Autor: OMS-WHO, Licence: CC BY-SA 3.0
Map of the 22 HBCs (high-burden countries) that account for approximately 80% of all new TB cases arising each year. Source: WHO Report 2009 - Global Tuberculosis Control, Table 1.2 "Estimated epidemiological burden of TB in 2007"
This technician is in the process of correctly placing a Mantoux tuberculin skin test in this recipient’s forearm, which will cause a 6mm to10mm wheal, i.e., a raised area of skin surface, to form at the injection site. The Mantoux tuberculin skin test is used to evaluate people for latent tuberculosis (TB) infection. In the United States, this skin test consists of an intradermal injection of exactly one tenth of a milliliter (mL) of tuberculin, which contains 5 tuberculin units. Correct placement of this intradermal injection involves inserting the needle bevel slowly at a 5° to 15° angle. The needle bevel is advanced through the epidermis, the superficial layer of skin, approximately 3mm so that the entire bevel is covered and lies just under the skin surface. A tense, pale wheal that is 6mm to 10mm in diameter appears over the needle bevel.
Autor: Gutierrez MC, Brisse S, Brosch R, Fabre M, Omaïs B, Marmiesse M, Supply P, Vincent V., Licence: CC BY 3.0
Phylogenetic Position of the Tubercle Bacilli within the Genus Mycobacterium. The blue triangle corresponds to tubercle bacilli sequences that are identical or differing by a single nucleotide. The sequences of the genus Mycobacterium that matched most closely to those of M. tuberculosis were retrieved from the BIBI database (http://pbil.univ-lyon.fr/bibi/) and aligned with those obtained for 17 smooth and MTBC strains. The unrooted neighbor-joining tree is based on 1,325 aligned nucleotide positions of the 16S rRNA gene. The scale gives the pairwise distances after Jukes-Cantor correction. Bootstrap support values higher than 90% are indicated at the nodes.
Predominantly white poster with black and red lettering. Title at top of poster. Visual image is an illustration of a man holding a handkerchief over his mouth. Caption and publisher information below illustration.
Photomicrograph of a sputum sample containing Mycobacterium tuberculosis. M. tuberculosis bacteria can attack any part of the body, but usually the lungs causing Tuberculosis. It is spread when infected individuals cough or sneeze, releasing microdroplets into the air that contain the bacteria, which others then inhale.
(c) Lokal_Profil, CC BY-SA 2.5
Age-standardised disability-adjusted life year (DALY) rates from Tuberculosis by country (per 100,000 inhabitants).
An anteroposterior X-ray of a patient diagnosed with advanced bilateral pulmonary tuberculosis. This AP X-ray of the chest reveals the presence of bilateral pulmonary infiltrate (white triangles), and „caving formation“ (black arrows) present in the right apical region.The diagnosis is far-advanced tuberculosis.
Bakterie Mycobacterium tuberculosis, původce TBC.
I am author, created from data in annex 2 of Global tuberculosis control - surveillance, planning, financing WHO Report 2006 http://www.who.int/tb/publications/global_report/2006/en/
Main symptoms of different variants and stages of tuberculosis (See Wikipedia:Tuberculosis), with many symptoms overlapping with other variants, while others are more (but not entirely) specific for certain variants. Multiple variants may be present simultaneously.
Model: Mikael Häggström. To discuss image, please see Template talk:Häggström diagrams
Estimated prevalence of tuberculosis per 100,000 people in 2007, per country.















