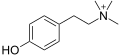
Tyramin
| Tyramin | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | 4-(2-aminoethyl)fenol |
| Anglický název | Tyramine |
| Německý název | Tyramin |
| Sumární vzorec | C8H11NO |
| Identifikace | |
| Registrační číslo CAS | 51-67-2 |
| PubChem | 5610 |
| SMILES | Oc1ccc(cc1)CCN |
| InChI | InChI=1S/C8H11NO/c9-6-5-7-1-3-8(10)4-2-7/h1-4,10H,5-6,9H2 |
| Vlastnosti | |
| Molární hmotnost | 137,179 g/mol |
| Teplota tání | 164,5 °C |
| Teplota varu | 206 °C (25 mmHg) 166 °C (2 mmHg) |
| Bezpečnost | |
| [1] Varování[1] | |
Některá data mohou pocházet z datové položky. | |
Tyramin (4-(2-aminoethyl)fenol) je v přírodě se vyskytující stopový amin odvozený z aminokyseliny tyrosinu.[2] Tyramin působí jako činidlo uvolňující katecholaminy. Není schopen překročit hematoencefalickou bariéru, což má za následek pouze nepsychoaktivní periferní sympatomimetické účinky po požití. Hypertenzní krize však může vyplynout z požití potravy bohaté na tyramin ve spojení s inhibitory monoaminooxidázy (MAOI).
Výskyt
Tyramin se vyskytuje u mnoha rostlin[3] a zvířat a je metabolizován různými enzymy, včetně monoaminooxidáz. V potravinách se často vyrábí dekarboxylací tyrosinu během fermentace nebo rozkladu. Potraviny, které obsahují značné množství tyraminu, zahrnují nakládané, uleželé, uzené, fermentované nebo marinované maso. V potravinách je dále v čokoládě a alkoholických nápojích, ale také ve fermentovaných potravinách např. sýrech, zakysané smetaně, jogurtu, krevetách, sojové omáčce, sójovém koření, teriyaki omáčce, tempehu, miso polévce, zelí, kimčchi, nebo v širokých (fava) fazolích.
Medicínské účinky
Důkaz o přítomnosti tyraminu v lidském mozku byl potvrzen.[4] Možnost, že tyramin působí přímo jako neuromodulátor, byla potvrzena objevem receptoru s G proteinem s vysokou afinitou k tyraminu, nazývaného TAAR1. [5] [6] Receptor TAAR1 se nachází v mozku, stejně jako v periferních tkáních, včetně ledvin.[7] Tyramin se váže jak na TAAR1, tak na TAAR2 jako na agonistu u lidí.[8]
Tyramin je fyziologicky metabolizován monoaminooxidázami (primárně MAO-A ), FMO3, PNMT, DBH a CYP2D6.[9][10][11][12][13] U člověka, pokud je metabolismus monoaminů ohrožen použitím inhibitorů monoaminooxidázy (MAOI) a potravou s vysokým obsahem tyraminu, může dojít k hypertenzní krizi, protože tyramin může také přemístit uložené monoaminy, jako je dopamin, norepinefrin a epinefrin, z pre- synaptické vezikuly.
První známky toho objevil britský lékárník, který si všiml, že jeho manželka, která v té době byla na léčbě MAOI, měla při jídle sýra bolesti hlavy.[14] Z tohoto důvodu se krize stále nazývá „sýrový účinek“ nebo „sýrová krize“, i když jiné potraviny mohou způsobit stejný problém.[15] :s.30–31
Většina zpracovaných sýrů neobsahuje dostatečné množství tyraminu, které by způsobilo hypertenzní účinky, i když některé staré sýry (například Stilton) obsahují.[16][17]
Velký příjem tyraminu ve stravě (nebo diuretický příjem tyraminu při užívání inhibitorů MAO) může způsobit odezvu tyraminového tlaku, což je definováno jako zvýšení systolického krevního tlaku o 30 mmHg nebo více. Zvýšené uvolňování norepinefrinu (noradrenalinu) z neuronálních cytosolů nebo ve skladovacích vezikulech má za následek vazokonstrikci a zvýšenou srdeční frekvenci a krevní tlak odezvy pacienta. V těžkých případech může dojít k adrenergní krizi. Ačkoliv mechanismus je nejasný, tyramin také spouští migrény u citlivých jedinců. Vasodilatační, dopaminové a oběhové faktory se podílejí na migréně. Dvojitě zaslepené studie naznačují, že účinky tyraminu na migrény mohou být adrenergní.[18] Nemoc má nadměrně zastoupeni mezi těmi, kteří mají nedostatečnou přirozenou monoaminooxidázu, což vede k podobným problémům u jedinců užívajících inhibitory MAO. Mnoho spouštěčů migrény má vysoký obsah tyraminu.[19]
Pokud se člověk opakovaně vystavil působení tyraminu, dochází ke snížení tlaku ; tyramin je degradován na octopamin, který je následně zabalen v synaptických vezikulech s norepinefrinem (noradrenalinem). Z tohoto důvodu, po opakované expozici tyraminu, tyto váčky obsahují zvýšené množství oktopaminu a relativně snížené množství norepinefrinu. Když jsou tyto vezikuly vylučovány při požití tyraminu, dochází ke snížené odezvě na tlak, protože méně norepinefrinu se vylučuje do synapse a oktopamín neaktivuje alfa nebo beta adrenergní receptory. Při použití inhibitoru MAO (MAOI) je příjem přibližně 10 až 25 mg tyraminu je zapotřebí pro těžkou reakci ve srovnání s 6 až 10 mg pro mírnou reakci. Výzkum odhaluje možné spojení mezi migrénou a zvýšenými hladinami tyraminu. V přehledu z roku 2007 publikovaném v časopise Neurological Sciences[20] předloženy údaje ukazující, že migréna a klastrové bolesti hlavy jsou charakterizovány zvýšením cirkulujících neurotransmiterů a neuromodulátorů (včetně tyraminu, octopaminu a synefrinu ) v hypotalamu, amygdálí a dopaminergním systému.
Biosyntéza
Biochemicky se tyramin vyrábí dekarboxylací tyrosinu působením enzymu tyrozinkarboxylázy.[21] Tyramin může být zase převedeny na methylované alkaloidů deriváty N-methyltyramin, N,N-dimethyltyramin (hordenin), a N,N,N-trimethyltyramin (kandicin).
- tyramin
- N-methyltyramin
- N,N-dimethyltyramin (hordenin)
- N,N,N-trimethyltyramin (kandicin)
U lidí se tyramin produkuje z tyrosinu.
Chemie
V laboratoři může být tyramin syntetizován různými způsoby, zejména také dekarboxylací tyrosinu.[22][23][24]

Právní status
Spojené státy
Tyramine není listován na federální úrovni ve Spojených státech, a je proto legální.[25]
Reference
V tomto článku byl použit překlad textu z článku Tyramine na anglické Wikipedii.
- ↑ a b Tyramine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ tyramine | C8H11NO [online]. [cit. 2017-04-08]. Dostupné online. (anglicky)
- ↑ TA Smith (1977) Phytochemistry 16, 9-18.
- ↑ PHILIPS, ROZDILSKY BOULTON. Evidence for the presence of m-tyramine, p-tyramine, tryptamine, and phenylethylamine in the rat brain and several areas of the human brain.. Biological Psychiatry. Feb 1978, s. 51–57. PMID 623853.
- ↑ NAVARRO, GILMOUR LEWIN. A Rapid Functional Assay for the Human Trace Amine-Associated Receptor 1 Based on the Mobilization of Internal Calcium. J Biomol Screen. 10 July 2006, s. 668–693. doi:10.1177/1087057106289891. PMID 16831861.
- ↑ LIBERLES, BUCK. A second class of chemosensory receptors in the olfactory epithelium. Nature. 10 August 2006, s. 645–650. Dostupné online. doi:10.1038/nature05066. PMID 16878137.
- ↑ XIE, WESTMORELAND MILLER. Modulation of monoamine transporters by common biogenic amines via trace amine-associated receptor 1 and monoamine autoreceptors in human embryonic kidney 293 cells and brain synaptosomes.. J. Pharm.. May 2008, s. 629–640. doi:10.1124/jpet.107.135079. PMID 18310473.
- ↑ Khan MZ, Nawaz W. The emerging roles of human trace amines and human trace amine-associated receptors (hTAARs) in central nervous system. Biomed. Pharmacother.. October 2016, s. 439–449. doi:10.1016/j.biopha.2016.07.002. PMID 27424325.
- ↑ Trimethylamine monooxygenase (Homo sapiens). [s.l.]: Technische Universität Braunschweig, July 2016. Dostupné online.
- ↑ Krueger SK, Williams DE. Mammalian flavin-containing monooxygenases: structure/function, genetic polymorphisms and role in drug metabolism. Pharmacol. Ther.. June 2005, s. 357–387. doi:10.1016/j.pharmthera.2005.01.001. PMID 15922018.
Table 5: N-containing drugs and xenobiotics oxygenated by FMO - ↑ Broadley KJ (březen 2010). "Cévní účinky stopových aminů a amfetaminů". Pharmacol. Ther . 125 (3): 363-375. dva : 10.1016 / j.pharmthera.2009.11.005 . PMID 19948186 .
- ↑ Lindemann L, Hoener MC (květen 2005). "Renesance v stopách amines inspirovaných novou rodinou GPCR". Trends Pharmacol. Sci . 26 (5): 274-281. doi : 10.1016 / j.tips.2005.03.007 . PMID 15860375 .
- ↑ Wang X, Li J, Dong G, Yue J (únor 2014). "Endogenní substráty mozku CYP2D". Eur. J. Pharmacol . 724 : 211-218. dva : 10.1016 / j.ejphar.2013.12.025 . PMID 24374199 .
- ↑ Sathyanarayana Rao TS a Vikram K. Yeragani VK (2009) "Hypertenzivní krize a sýr" Indián J Psychiatrie . 51 (1): 65-66.
- ↑ E. Siobhan Mitchell "Antidepresiva" Archivováno 3. 4. 2019 na Wayback Machine. , kapitola Drugs, Straight Facts , vydal David J. Triggle. 2004, vydavatelé Chelsea House
- ↑ Stahl SM, Felker A. Monoamine oxidase inhibitors: a modern guide to an unrequited class of antidepressants. Cns Spectrums. 2008, s. 855–870. Dostupné online. PMID 18955941.
- ↑ Tyramin-omezená dieta Archivováno 13. 5. 2014 na Wayback Machine. [1] Archivováno 13. 5. 2014 na Wayback Machine. 1998, společnost WB Saunders.
- ↑ GHOSE, K.; COPPEN, A.; CARROL, D. Intravenous tyramine response in migraine before and during treatment with indoramin.. Br Med J. 1977-05-07, s. 1191–1193. Dostupné online. ISSN 0007-1447. doi:10.1136/bmj.1.6070.1191. PMID 324566. (anglicky)
- ↑ Archivovaná kopie. www.headaches.org. Dostupné v archivu pořízeném dne 2017-07-02. Archivováno 2. 7. 2017 na Wayback Machine.
- ↑ D'ANDREA, G; NORDERA, GP; PERINI, F; ALLAIS, G; GRANELLA, F. Biochemistry of neuromodulation in primary headaches: focus on anomalies of tyrosine metabolism. Neurological Sciences. May 2007, s. S94–S96. Dostupné online. doi:10.1007/s10072-007-0758-4. PMID 17508188.[nedostupný zdroj]
- ↑ Metabolismus tyrosinu - Referenční cesta Archivováno 26. 7. 2019 na Wayback Machine. , Kjótská encyklopedie genů a genomů (KEGG)
- ↑ G. Barger. CXXVII.?Isolation and synthesis of p-hydroxyphenylethylamine, an active principle of ergot soluble in water. J. Chem. Soc.. 1909, s. 1123–1128. doi:10.1039/ct9099501123.
- ↑ WASER, Ernst. Untersuchungen in der Phenylalanin-Reihe VI. Decarboxylierung des Tyrosins und des Leucins. Helvetica Chimica Acta. 1925, s. 758–773. doi:10.1002/hlca.192500801106.
- ↑ BUCK, Johannes S. Reduction of Hydroxymandelonitriles. A New Synthesis of Tyramine. Journal of the American Chemical Society. 1933, s. 3388–3390. doi:10.1021/ja01335a058.
- ↑
Externí odkazy
 Obrázky, zvuky či videa k tématu tyramin na Wikimedia Commons
Obrázky, zvuky či videa k tématu tyramin na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Chemical structure of candicine (trimethyltyramine)
Chemical structure of dimethyltyramine (hordenine)
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the tyramine molecule, a compound partially responsible for the 'cheese effect'.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Oxygen, O: red
- Nitrogen, N: blue
Autor: Nuklear, Licence: CC BY-SA 3.0
A synthetic scheme for the production of tyramine is disclosed.
Chemical structure of N-methyltyramine
2D structure of thyramine