Ubiquitin
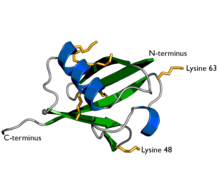
Ubiquitin či ubikvitin (z lat. ubique, všude) je malý globulární polypeptid o délce 76 aminokyselin a velikosti 8,6 kDa. Byl objeven Gideonem Goldsteinem roku 1975 a od té doby byl extenzivně studován[1]. Ubiquitin je přítomný ve všech eukaryotických buňkách, kde reguluje celou řadu funkcí jiných proteinů jako jejich buněčnou lokalizaci, stabilitu a rozklad v proteazomu, lyzozomu či ve vakuole. V určitých případech však také stimuluje endocytózu, vnitrobuněčný transport a podílí se na udržování struktury chromatinu (vazbou na histony)[2].
Ubiquitin reguluje funkci jiných proteinů procesem zvaným ubiquitinylace (příp. ubiquitinace, ubikvitinylace). Jedná se o kovalentní post-translační modifikaci proteinů, která hraje významnou roli ve stabilitě a degradaci proteinů, jejich buněčném umístění a aktivitě. Ubiquitin může být na protein navázán ve formě monomeru nebo polyubikquinových řetězců. Ubiquitin je u lidí kódován čtyřmi geny: UBB, UBC, RPS27A a UBA52[3].
Struktura
Ubiquitin je 76 aminokyselin dlouhý, kompaktní protein[4]. Jedná se o jeden z nejvíce konzervovaných eukaryotických proteinů[5].
Ubiquitin je exprimován ve formě prekurzorů: i) polyubiquitin složený z několika ubiquitinových jednotek v head-to-tail orientaci (u člověka kódován UBB, UBC) a ii) fúzní protein, kde je ubiquitin navázán zpravidla na ribozomální proteiny (u člověka RPS27A a UBA52), které jsou následně enzymaticky štěpeny na monomery ubiquitinu.
Aminokyselinová sekvence: MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPDQQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG
Ubikvitinylace
Ubikvitinylace je typ post-translační modifikace proteinů, kdy je ubiquitin kovalentně připojen na substrátový protein. Nejčastěji se ubiquitin váže svým C-koncovým glycinem (G76) na lysin substrátu. Vzniká tak peptidická vazba mezi COO- skupinou ubiquitinu a ε-NH3+ lysinu substrátového proteinu [6].
Ubikvitinylace vyžaduje sled reakcí pro jsou nezbytné tři typy enzymů: ubiquitin-aktivující enzym (E1), ubiquitin-konjugující enzym (E2) a ubiquitin ligáza (E3).
- Aktivace (ATP závislá): Ubiquitin je aktivován dvou krokovou reakcí katalyzovanou E1 ubiquitin-aktivujícím enzymem. E1 váže ubiquitin a ATP a katalyzuje adenylaci C-koncového glycinu ubiquitinu za současného uvolnění pyrofosfátu. Následně je aktivovaný ubiquitin navázán thioesterovou vazbou na cystein E1 enzymu za uvolnění AMP.
- Konjugace: aktivovaný ubiquitin je dále přenesen trans-acetylací na E2 ubiquitin-konjugující enzym, který dále selektivně reaguje s E3 ubiquitin-ligázou. Zdá se, že při tvorbě polyubiquitinových řetězců je E2 enzym zodpovědný za rozhodnutí o jaký typ řetězce půjde a tím rozhoduje o osudu ubiquitinylovaných proteinů[7].
- Ligace: ligace může probíhat přímým přenosem ubiquitinu z E2 na substrát (v případě ubikvitinylace histonů) nebo pomocí E3 ubiquvitin-ligázy. Ubiquitin ligáza nejdřív váže substrátový protein a následně katalyzuje přenos ubiquitinu z E2 na substrát. E3 ubiquitin-ligáza je enzym zodpovědný za volbu substrátu, na který bude ubiquitin navázán[7][8].
Do dnešní doby bylo u člověka identifikováno pouze několik E1 enzymů, desítky E2 enzymů a stovky E3 ubiquitin-ligáz. Tyto počty reflektují hierarchické uspořádání a substrátovou specifitu daných enzymů.
Polyubiquitin
Ubiquitin se může vázat na jiné proteiny jako monomer nebo ve formě řetězců, kde jedna molekula ubiquitinu navázána na další. Ubiquitin obsahuje 7 lysinových zbytků (K6, K11, K27, K29, K33, K48, K63) a N-koncový methionin (M1) na které se může vázat další molekula ubiquitinu. Nejlépe charakterizované jsou K48, K63.
K48-vázané polyubiquitinové řetězce byly první identifikované[9]. K48-vázané řetězce jsou velmi kompaktní Tento typ řetězců hraje významnou roli v degradaci proteinů proteolýzou. Proteiny označené navázaným K48-polyubiquitinem mohou být rozeznány 26S proteazomem, který zapříčiní rozštěpení proteinů na peptidy. K48-polyubiquitinace hraje významnou roli v homeostázi a obratu proteinů. Minimální délka řetězce potřebná pro rozeznání proteazomem jsou 4 molekuly ubiquitinu[10].
K63-vázaný polyubiquitin neslouží ke značení proteinů k degradaci, naopak může zvyšovat jejich stabilitu a přispívat ke stabilitě signálních komplexů. Oproti K48-vázaným řetězcům jsou K63-vázané mnohem volnější.
M1-vázaný polyubiquitin (také lineární polyubiquitin) je další typ řetězce, který neslouží k označení pro degradaci. V tomto případě je ubiquitin vázán v head-to-tail orientaci, kde C-koncový glycin se váže přímo na N-koncový methionin. Přestože se původně myslelo, že M1-vázaný ubiquitin, podobně jako K48, slouží k proteinové degradaci[11], lineární ubiquitin se později ukázal jako nezbytný pro signalizaci přes NF-kB[12]. V současné době je známa pouze jedna E3 ligáza schopná tvořit lineární polyubiquitinové řetězce – linear ubiquitin chain assembly complex (LUBAC)[13][14].
Reference
- ↑ GOLDSTEIN, G; SCHEID, M; HAMMERLING, U. Isolation of a polypeptide that has lymphocyte-differentiating properties and is probably represented universally in living cells.. Proceedings of the National Academy of Sciences. 1975-01, roč. 72, čís. 1, s. 11–15. Dostupné online [cit. 2023-03-12]. ISSN 0027-8424. DOI 10.1073/pnas.72.1.11. PMID 1078892. (anglicky)
- ↑ ROBERT C. KING; WILLIAM D. STANSFIELD; PAMELA K. MULLIGAN. A Dictionary of Genetics, Seventh Edition. [s.l.]: Oxford University Press, 2006.
- ↑ KIMURA, Y.; TANAKA, K. Regulatory mechanisms involved in the control of ubiquitin homeostasis. Journal of Biochemistry. 2010-06-01, roč. 147, čís. 6, s. 793–798. Dostupné online [cit. 2023-03-12]. ISSN 0021-924X. DOI 10.1093/jb/mvq044. (anglicky)
- ↑ WILKINSON, K. D.; AUDHYA, T. K. Stimulation of ATP-dependent proteolysis requires ubiquitin with the COOH-terminal sequence Arg-Gly-Gly. The Journal of Biological Chemistry. 1981-09-10, roč. 256, čís. 17, s. 9235–9241. PMID: 6267067. Dostupné online [cit. 2023-03-12]. ISSN 0021-9258. PMID 6267067.
- ↑ VIJAY-KUMAR, Senadhi; BUGG, Charles E.; COOK, William J. Structure of ubiquitin refined at 1.8 Å resolution. Journal of Molecular Biology. 1987-04, roč. 194, čís. 3, s. 531–544. Dostupné online [cit. 2023-03-12]. DOI 10.1016/0022-2836(87)90679-6. (anglicky)
- ↑ HERSHKO, Avram; CIECHANOVER, Aaron. THE UBIQUITIN SYSTEM. Annual Review of Biochemistry. 1998-06, roč. 67, čís. 1, s. 425–479. Dostupné online [cit. 2023-03-12]. ISSN 0066-4154. DOI 10.1146/annurev.biochem.67.1.425. (anglicky)
- ↑ a b WIJK, Sjoerd J. L.; TIMMERS, H. T. Marc. The family of ubiquitin‐conjugating enzymes (E2s): deciding between life and death of proteins. The FASEB Journal. 2010-04, roč. 24, čís. 4, s. 981–993. Dostupné online [cit. 2023-03-12]. ISSN 0892-6638. DOI 10.1096/fj.09-136259. (anglicky)
- ↑ HERSHKO, Avram; CIECHANOVER, Aaron. THE UBIQUITIN SYSTEM FOR PROTEIN DEGRADATION. Annual Review of Biochemistry. 1992-06, roč. 61, čís. 1, s. 761–807. Dostupné online [cit. 2023-03-12]. ISSN 0066-4154. DOI 10.1146/annurev.bi.61.070192.003553. (anglicky)
- ↑ CHAU, Vincent; TOBIAS, John W.; BACHMAIR, Andreas. A Multiubiquitin Chain Is Confined to Specific Lysine in a Targeted Short-Lived Protein. Science. 1989-03-24, roč. 243, čís. 4898, s. 1576–1583. Dostupné online [cit. 2023-03-12]. ISSN 0036-8075. DOI 10.1126/science.2538923. (anglicky)
- ↑ THROWER, J. S. Recognition of the polyubiquitin proteolytic signal. The EMBO Journal. 2000-01-04, roč. 19, čís. 1, s. 94–102. Dostupné online [cit. 2023-03-12]. DOI 10.1093/emboj/19.1.94. PMID 10619848.
- ↑ NAKAMURA, Munehiro; TOKUNAGA, Fuminori; SAKATA, Shin-ichi. Mutual regulation of conventional protein kinase C and a ubiquitin ligase complex. Biochemical and Biophysical Research Communications. 2006-12-15, roč. 351, čís. 2, s. 340–347. Dostupné online [cit. 2023-03-12]. ISSN 0006-291X. DOI 10.1016/j.bbrc.2006.09.163. (anglicky)
- ↑ TOKUNAGA, Fuminori; SAKATA, Shin-ichi; SAEKI, Yasushi. Involvement of linear polyubiquitylation of NEMO in NF-κB activation. Nature Cell Biology. 2009-02, roč. 11, čís. 2, s. 123–132. Dostupné online [cit. 2023-03-12]. ISSN 1476-4679. DOI 10.1038/ncb1821. (anglicky)
- ↑ KIRISAKO, Takayoshi; KAMEI, Kiyoko; MURATA, Shigeo. A ubiquitin ligase complex assembles linear polyubiquitin chains. The EMBO Journal. 2006-10-18, roč. 25, čís. 20, s. 4877–4887. Dostupné online [cit. 2023-03-12]. ISSN 0261-4189. DOI 10.1038/sj.emboj.7601360. PMID 17006537.
- ↑ GERLACH, Björn; CORDIER, Stefanie M.; SCHMUKLE, Anna C. Linear ubiquitination prevents inflammation and regulates immune signalling. Nature. 2011-03, roč. 471, čís. 7340, s. 591–596. Dostupné online [cit. 2023-03-12]. ISSN 1476-4687. DOI 10.1038/nature09816. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu ubiquitin na Wikimedia Commons
Obrázky, zvuky či videa k tématu ubiquitin na Wikimedia Commons
Média použitá na této stránce
Autor: Rogerdodd, Licence: CC BY-SA 3.0
Cartoon representation of ubiquitin protein, highlighting the secondary structure. α-helices are coloured in blue and β-strands in green. The sidechains of the 7 lysine residues are indicated by orange sticks. The two best-characterised attachment points for further ubiquitin molecules in polyubiquitin chain formation (lysines 48 & 63) are labelled. Image was created using PyMOL from PDB id 1ubi.
