Vaskův komplex
| Vaskův komplex | |
|---|---|
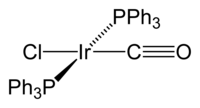 Strukturní vzorec | |
 Strukturní vzorec | |
| Obecné | |
| Systematický název | (SP-4-1)-karbonylchloridobis(trifenylfosfan)iridium(I) |
| Sumární vzorec | IrC37H30P2OCl |
| Identifikace | |
| Registrační číslo CAS | 14871-41-1 |
| SMILES | c1ccc(cc1)[P+](c2ccccc2)(c3ccccc3)[Ir-2](=C=O)([P+](c4ccccc4)(c5ccccc5)c6ccccc6)Cl |
| InChI | InChI=1S/2C18H15P.CO.ClH.Ir/c2*1-4-10-16(11-5-1)19(17-12-6-2-7-13-17)18-14-8-3-9-15-18;1-2;;/h2*1-15H;;1H;/q;;;;-1/p+1 |
| Vlastnosti | |
| Molární hmotnost | 780,25 g/mol |
| Teplota tání | 215 °C (488 K) (rozkládá se) |
| Rozpustnost ve vodě | nerozpustný |
| Bezpečnost | |
| S-věty | S22 S24/25 |
Některá data mohou pocházet z datové položky. | |
Vaskův komplex je triviální název komplexní sloučeniny se systematickým názvem (SP-4-1)-karbonylchloridobis(trifenylfosfan)iridium(I). Molekula této látky má čtvercovou rovinnou geometrii s centrem tvořeným atomem iridia, na které jsou ve vzájemné poloze trans navázány dva trifenylfosfinové ligandy, oxid uhelnatý a chloridový anion. Komplex vykazuje diamagnetické vlastnosti. Poprvé jej popsali J. W. DiLuzio a Lauri Vaska v roce 1961.[1] Vaskův komplex se může účastnit oxidačních adicí a mohou se na něj vratně vázat molekuly O2.
Příprava
Vaskův komplex se připravuje zahříváním některého z chloridů iridia s trifenylfosfinem a zdrojem oxidu uhelnatého. Při nejpoužívanější metodě přípravy se jako rozpouštědlo používá dimethylformamid, do kterého se někdy za účelem urychlení reakce přidává anilin; jako rozpouštědlo lze také použít 2-methoxyethanol. Reakce se obvykle provádí v dusíkové atmosféře. Trifenylfosfin slouží jak jako ligand, tak i jako redukční činidlo, karbonylový ligand se vytvoří rozkladem dimethylformamidu. Níže je uvedena možná rovnice reakce:[2]
- IrCl3(H2O)3 + 3 P(C6H5)3 + HCON(CH3)2 + C6H5NH2 → IrCl(CO)[P(C6H5)3]2 + [(CH3)2NH2]Cl + OP(C6H5)3 + [C6H5NH3]Cl + 2 H2O
Nejčastějšími zdroji iridia pro přípravu Vaskova komplexu jsou chlorid iriditý a H2IrCl6.
Reakce
Vaskův komplex je možné využít k homogenní katalýze. S 16 valenčními elektrony je označován jako „koordinačně nenasycený“ komplex a tak se na něj mohou navázat dva jednoelektronové nebo jeden dvouelektronový ligand, čímž se s 18 elektrony stane koordinačně nasyceným. Toto přidáním dvou elektronů se nazývá oxidační adice.[3] Při této oxidační adici se oxidační číslo iridia zvýší z I na III. Tetrakoordinovaná čtvercová struktura v původním komplexu se změní na osmistěnnou a hexakoordinovanou. Vaskův komplex vstupuje do oxidačních adicí s běžnými oxidačními činidly, jako jsou halogeny, silné kyseliny, jako například HCl a i jiné látky, které mohou fungovat jako elektrofily, například jodmethan (CH3I).
Vaskův komplex na sebe vratně váže kyslík:
- IrCl(CO)[P(C6H5)3]2 + O2 ⇌ IrCl(CO)[P(C6H5)3]2O2
Dikyslíkový ligand se na něj váže oběma atomy kyslíku a uvolnit jej lze zahřátím nebo přidáním inertního plynu; odstranění ligandu se projeví změnou barvy z oranžové na žlutou.[2]
Spektroskopie
Produkty oxidačních adicí katalyzovaných Vaskovým komplexem lze analyzovat pomocí infračervené spektroskopie, protože tyto reakce vykazují charakteristické posuny frekvencí vibrací vazby u navázaného oxidu uhelnatého.[4] Frekvence těchto vibrací byly popsány v odborném tisku.[5]
- Vaskův komplex: 1967 cm−1
- Vaskův komplex + O2: 2015 cm−1
- Vaskův komplex + CH3I: 2047 cm−1
- Vaskův komplex + I2: 2067 cm−1
Oxidační adicí u Vaskova komplexu vznikají iridité sloučeniny a dochází přitom k redukci pí vazeb C-Ir, což způsobuje nárůst frekvence natahování karbonylové vazby. Přesné hodnoty této frekvence závisí na použitém ligandu, u iriditých komplexů vždy však přesahují 2000 cm−1.
Reference
V tomto článku byl použit překlad textu z článku Vaska's complex na anglické Wikipedii.
- ↑ Lauri Vaska; J. W. DiLuzio. Carbonyl and Hydrido-Carbonyl Complexes of Iridium by Reaction with Alcohols. Hydrido Complexes by Reaction with Acid. Journal of the American Chemical Society. 1961, s. 2784–2785. DOI 10.1021/ja01473a054.
- ↑ a b G. S. Girolami; T. B. Rauchfuss; R. J. Angelici. Synthesis and Technique in Inorganic Chemistry. [s.l.]: University Science Books, 1999. Dostupné online. ISBN 0-935702-48-2. S. 190.
- ↑ Jay A. Labinger. Tutorial on Oxidative Addition. Organometallics. 2015, s. 4784–4795. DOI 10.1021/acs.organomet.5b00565.
- ↑ Lauri Vaska; J. W. DiLuzio. Activation of Hydrogen by a Transition Metal Complex at Normal Conditions Leading to a Stable Molecular Dihydride. Journal of the American Chemical Society. 1962, s. 679–680. DOI 10.1021/ja00863a040.
- ↑ R. Crabtree. The Organometallic Chemistry of the Transition Metals. [s.l.]: John Wiley & Sons, 2001. S. 152.
Externí odkazy
 Obrázky, zvuky či videa k tématu Vaskův komplex na Wikimedia Commons
Obrázky, zvuky či videa k tématu Vaskův komplex na Wikimedia Commons

