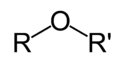Vazba uhlík–kyslík
Vazba uhlík–kyslík (C–O) je kovalentní vazba mezi atomy uhlíku a kyslíku.[1][2][3] Kyslík má 6 valenčních elektronů a upřednostňuje buď sdílení dvou elektronů s uhlíkovým atomem, kdy zbylé čtyři nevazebné elektrony utvoří dva volné elektronové páry :O:, nebo sdílení dvou párů elektronů za tvorby karbonylové skupiny. =O: Příklady sloučenin mohou být _OH u alkoholů, například ethanolu, a C=O u ketonů (a dalších karbonylových sloučenin).[4]
Elektronegativity a délky vazeb
Vazby C–O jsou silně polarizovány směrem ke kyslíku (elektronegativita uhlíku je C 2,55 a u kyslíku 3,44). Délky jednoduchých vazeb C–O se pohybují okolo 143 pm a jsou tak kratší než odpovídající vazby C–N a C–C. O něco kratší jsou jednoduché vazby v karboxylových kyselinách (136 pm) kvůli částečné povaze dvojné vazby, delší jsou v epoxidech (147 pm).[5] Vazebné energie jsou u vazeb C–O rovněž vyšší než u C–N a C–C, například vazby C–O v molekule methanolu mají (při 298 K) energii přibližně 380 kJ/mol, u methylaminu jde přibližně o 360 kJ/mol a u ethanu 370 kJ/mol.[5]
Koncové dvojné vazby mezi uhlíkovými a kyslíkovými atomy se vyskytují v karbonylových sloučeninách, jako jsou ketony, estery a karboxylové kyseliny. Vnitřní vazby C=O se nacházejí u oxoniových kationtů. Ve furanech se kyslíkový atom podílí na delokalizaci pí elektronů svým zaplněným p orbitalem a furany jsou tak aromatické. Délky vazeb C=O se u karbonylových sloučenin pohybují okolo 123 pm, v oxidu uhličitém je vazba C=O 116 pm dlouhá. U acylhalogenidů mají vazby C=O částečný charakter trojné vazby a jsou tak krátké (117 pm). Sloučeniny s formálně trojnými vazbami C ≡O nejsou známy, s výjimkou oxidu uhelnatého (délka 112,8 pm). Tyto trojné vazby mají vysoké energie, ještě vyšší než u trojné vazby N–N.[6]
Kyslík může být také trojvazný, jako příklad sloučeniny lze použít triethyloxoniumtetrafluoroborát.
Tvorba
K reakcím vytvářejícím vazby uhlík–kyslík patří Williamsonova syntéza etherů, nukleofilní acylová substituce a elektrofilní adice na alkeny. Karbonylové sloučeniny se při tvorbě vazeb C–O využívají například v Paternòvě–Büchiově reakci.
Příklady funkčních skupin
Vazby mezi atomy uhlíku a kyslíku se vyskytují v těchto funkčních skupinách:
| Skupina sloučenin | Řád vazby | Molekulový vzorec | Strukturní vzorec | Příklad sloučeniny |
|---|---|---|---|---|
| Alkoholy | 1 | R3C–OH |  | Ethanol |
| Ethery | 1 | R3C–O–CR3 |  | Diethylether |
| Peroxidy | 1 | R3C–O–O–CR3 |  | Di-terc-butylperoxid |
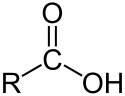
| Karboxylové kyseliny | 1 a 2 | R3C–CO–OH |  | 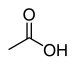 Kyselina octová |
| Estery karboxylových kyselin | 1 a 2 | R3C–CO–O–CR3 |  | Ethylakrylát |
| Estery kyseliny uhličité | 1 a 2 | R3C–O–CO–O–CR3 |  | 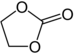 Ethylenkarbonát |
| Ketony | 2 | R3C–CO–CR3 |  | Aceton |
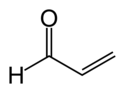
| Aldehydy | 2 | R3C–CHO |  |  Akrolein |
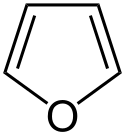
| Furany | 1,5 |  |  Furfural | |
| Pyryliové soli | 1,5 |  |  Anthokyaniny |
Reference
V tomto článku byl použit překlad textu z článku Carbon–oxygen bond na anglické Wikipedii.
- ↑ Organic Chemistry John McMurry 2nd Ed.
- ↑ March, J.; Smith, D. (2001). Advanced Organic Chemistry, 5th ed. New York: Wiley.
- ↑ Advanced Organic Chemistry Carey, Francis A., Sundberg, Richard J. 5th ed. 2007
- ↑ Jim Clark. Bonding in Carbonyl Compounds [online]. ChemGuide, 2000 [cit. 2014-06-12]. Dostupné online.
- ↑ a b CRC Handbook of Chemistry and Physics 65Th Ed.
- ↑ Standard Bond Energies [online]. Department of Chemistry, Michigan State University. Dostupné v archivu pořízeném z originálu dne 2016-08-29.
Média použitá na této stránce
benzopyrydilium salts
Structure of acetone
General structure of carboxylic acids
(c) Wolfmankurd na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Diethyl ether chemical structure
Structure of furan
Kohlensäureester_Strukturformel
Chemical diagram for di-tert-butyl peroxide
Structural formula of a general ester group (RCOOR'). Created with ChemDraw and Photoshop.
Ethanol chemical structure
Chemical diagram for a generic pyrylium salt
Chemical structure of furfural