Vazba uhlík–uhlík
Vazba uhlík–uhlík je kovalentní vazba mezi dvěma atomy uhlíku.[1]
Nejčastější podobou je jednoduchá vazba, tvořená dvojicí elektronů, jedním z každého atomu. Jednoduchá vazba uhlík–uhlík je druhu sigma a vzniká překryvem jednoho hybridizovaného orbitalu z každého atomu. V molekule ethanu jde o sp3-hybridizované orbitaly, existují však i vazby mezi uhlíky majícími jiné druhy hybridizace (například sp2 a sp2). Atomy uhlíku v jednoduché vazby nemusí ani mít stejnou hybridizaci. Mezi uhlíky se též mohou nacházet dvojné (u alkenů) nebo trojné vazby (u alkynů). Dvojná vazba se tvoří překryvem sp2-hybridizovaného orbitalu a p orbitalu nezapojeného do hybridizace. Trojná vazba vzniká z sp-hybridizovaného orbitalu a dvou p orbitalů z každého atomu. Zapojení p orbitalů vytváří vazbu typu pí.
Řetězce a větvení
Uhlík je jedním z mála prvků, které mohou tvořit dlouhé řetězce svých vlastních atomů, tato vlastnost se nazývá katenace a je způsobena vysokými energiemi vazeb uhlík–uhlík, což umožňuje vytvářet obrovské množství uspořádání molekul; mnohé z nich jsou obsaženy v živých organismech, sloučeniny uhlíku tak mají vlastní chemické odvětví: organickou chemii.
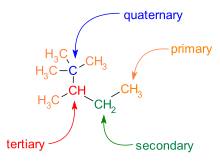
C-C řetězce jsou často rozvětvené. Uhlíkové atomy lze podle počtu dalších uhlíků na ně navázaných rozdělit takto:
- Na primární uhlík je navázán jeden další.
- Na sekundární se připojují dva.
- Terciární uhlík má na sebe připojené tři další uhlíky.
- Na kvartérní uhlíky jsou navázány čtyři jiné atomy uhlíku.
V „organických molekulách se složitou strukturou“ se vyskytují trojrozměrně uspořádané vazby uhlík–uhlík na kvartérních místech, které určují tvary molekul.[2] Tato kvartérní místa se nacházejí v řadě biologicky aktivních malých molekulách, jako jsou kortizon a morfin.[2]
Příprava
Reakce vytvářející vazby uhlík–uhlík mají velký význam při přípravě mnoha chemických látek, například léčiv a plastů.
Jako příklady reakcí lze uvést aldolové kondenzace, Dielsovy–Alderovy reakce, adice Grignardových činidel na karbonylové skupiny, Heckova reakce, Michaelova reakce a Wittigova reakce.
Postupy řízené syntézy trojrozměrných struktur obsahujících terciární uhlíky byly z velké části nalezeny do konce 20. století, ovšem syntézy sloučenin s kvaternárními uhlíky byly provedeny až začátkem 21. století.[2]
Délky a energie vazeb
Jednoduché vazby C-C jsou slabší než vazby C-H, O-H, N-H, H-H, H-Cl, C-F a řada dvojných či trojných vazeb, a podobně silné jako C-O, Si-O, P-O a S-H,[3] většinou jsou však považovány za silné.
| Vazba C–C | Molekula | Disociační energie vazby (kJ/mol) |
|---|---|---|
| CH3–CH3 | ethan | 380 |
| C6H5–CH3 | toluen | 430 |
| C6H5–C6H5 | bifenyl | 480 |
| CH3C(O)–CH3 | aceton | 350 |
| CH3–CN | acetonitril | 570 |
| CH3–CH2OH | ethanol | 370 |
Výše uvedené hodnoty patří k obvyklým pro vazby C-C; ojediněle se mohou objevit hodnoty výrazně mimo toto rozmezí.
| Molekula | Ethan | Ethen | Ethyn |
|---|---|---|---|
| Vzoerc | C2H6 | C2H4 | C2H2 |
| Skupina | alkany | alkeny | alkyny |
| Struktura | 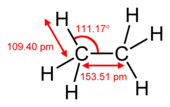 |  |  |
| Hybridizace uhlíků | sp3 | sp2 | sp |
| délka vazby C-C | 153,5 pm | 133,9 pm | 120,3 pm |
| Délka vazeb C-C ve srovnání s jednoduchými | 100 % | 87 % | 78 % |
| Metoda určení struktury | mikrovlnná spektroskopie | mikrovlnná spektroskopie | infračervená spektroskopie |
Mimořádné případy
Dlouhé a slabé jednoduché vazby C-C
Bylo objeveno několik případů neobvykle dlouhých vazeb C-C. V Gombergově dimeru má jedna vazba C-C délku 159,7 pm. Právě tato vazba se v roztoku snadno (a vratně) narušuje i za pokojové teploty:[5]
U hexakis(3,5-di-terc-butylfenyl)ethanu je energie vazby vytvářející stabilizovaný triarylmethylový radikál pouze 30 kJ/mol. V důsledku silného sterického působení je také centrální vazba v této molekule výrazně prodloužená, a to na 167 pm.[6]
Slabé dvojné vazby C-C
Struktura tetrakis(dimethylamino)ethylenu (TDAE) je značně narušená. Diedrální úhel dvou N2C konců je 28º, i když délka vazby C=C činí běžných 135 pm. Téměř izostrukturní tetraisopropylethylen má tuto vazbu také 135 pm dlouhou, jeho C6 jádro je ovšem rovinné.[7]
Krátké a silné trojné vazby C-C
Opačným extrémem je stav, kdy má jednoduchá vazba uhlík–uhlík v butadiynu nezvykle vysokou energii 670 kJ/mol, protože jednoduchá vazba spojuje dva sp-hybridizované uhlíky.[8]
Násobné vazby C-C jsou obecně silnější než jednoduché; dvojná vazba v ethenu má disociační energii 730 kJ/mol a u trojné vazby ethynu jde o 960 kJ/mol.[9]
Velmi krátkou trojnou vazbu (115 pm) pozorovanou u jodoniové sloučeniny [HC≡C–I+Ph][CF3SO3–], lze vysvětlit silným odtahováním elektronů jodonovou skupinou.[10]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Carbon–carbon bond na anglické Wikipedii.
- ↑ Harry Dembicki. Practical Petroleum Geochemistry for Exploration and Production. [s.l.]: Elsevier, 2016-10-06. ISBN 9780128033517. S. 7.
- ↑ a b c Quasdorf, Kyle W.; OVERMAN, LARRY E. Review: Catalytic enantioselective synthesis of quaternary carbon stereocentres. Nature. 2014, s. 181–191. DOI 10.1038/nature14007. PMID 25503231. Bibcode 2014Natur.516..181Q. (anglicky)
- ↑ Yu-Ran Luo and Jin-Pei Cheng "Bond Dissociation Energies" in CRC Handbook of Chemistry and Physics, 96th Edition.
- ↑ CRC Handbook of Chemistry and Physics, 88th edition
- ↑ L. N. Bochkarev; N. E. Molosnova; L. Zakharov; G. K. Fukin; A. I. Yanovsky; Y. T. Struchkov. 1-Diphenylmethylene-4-(triphenylmethyl)cyclohexa-2,5-diene Benzene Solvate. Acta Crystallographica Section C Crystal Structure Communications. 1995, s. 489–491. DOI 10.1107/S0108270194009005.
- ↑ Sören Rösel; Ciro Balestrieri; Peter R. Schreiner. Sizing the role of London dispersion in the dissociation of all-meta tert-butyl hexaphenylethane. Chemical Science. 2017, s. 405–410. ISSN 2041-6520. DOI 10.1039/c6sc02727j. PMID 28451185.
- ↑ Hans Bock; Horst Borrmann; Zdenek Havlas; Heinz Oberhammer; Klaus Ruppert; Arndt Simon. Tetrakis(dimethylamino)ethene: An Extremely Electron-Rich Molecule with Unusual Structure both in the Crystal and in the Gas Phase. Angewandte Chemie International Edition in English. 1991, s. 1678–1681. DOI 10.1002/anie.199116781.
- ↑ NIST Webbook [online]. Dostupné online.
- ↑ Stephen J. Blanksby; G. Barney Ellison. Bond Dissociation Energies of Organic Molecules. Accounts of Chemical Research. 2003, s. 255–263. ISSN 0001-4842. DOI 10.1021/ar020230d.
- ↑ Andrew Streitwieser; Clayton H. Heathcock; Edward M. Kosower. Introduction to organic chemistry. [s.l.]: Prentice Hall, 1992. ISBN 978-0139738500. S. 574.
Související články
Média použitá na této stránce
Autor: V8rik na projektu Wikipedie v jazyce angličtina, Licence: CC BY-SA 3.0
Substitution at carbon. 2,2,3-trimethylpentane.
Structural formula of the ethylene (ethene) molecule, C2H4. The molecule belongs to the D2h point group.
Structural information (determined by microwave spectroscopy) from CRC Handbook, 88th edition.Skeletal structures for the dissociation of Gomberg's dimer into triphenylmethyl radical
Structural formula of the ethane molecule, C2H6. In this staggered conformation, the molecule belongs to the D3d point group.
Structural information (determined by microwave spectroscopy) from CRC Handbook, 88th edition.Structural formula of the acetylene (ethyne) molecule, C2H2, with bond lengths. The molecule belongs to the D∞h point group. Structural information (determined by infrared spectroscopy) from CRC Handbook, 88th edition.





