Vinylacetát
| Vinylacetát | |
|---|---|
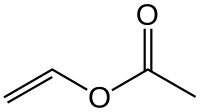 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | Ethenyl-ethanoát |
| Ostatní názvy | Ethenyl-acetát, ethenylester kyseliny ethanové, vinylester kyseliny octové |
| Anglický název | Vinyl acetate |
| Německý název | Vinylacetat |
| Funkční vzorec | H2C=CHOC(O)CH3 |
| Sumární vzorec | C4H6O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 108-05-4 |
| PubChem | 7904 |
| ChEBI | 46916 |
| SMILES | C=COC(C)=O |
| InChI | 1/C4H6O2/c1-3-6-4(2)5/h3H,1H2,2H3 |
| Vlastnosti | |
| Molární hmotnost | 86,089 g/mol |
| Teplota tání | −93,5 °C (159,6 K) |
| Teplota varu | 72,7 °C (345,8 K) |
| Hustota | 0,934 g/cm3 |
| Měrná magnetická susceptibilita | 5,39×105 μm3/g |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R11 |
| S-věty | S16 S23 S29 S33 |
| Teplota vzplanutí | −8 °C (265 K) |
| Teplota vznícení | 427 °C (700 K) |
| Meze výbušnosti | 2,6 až 13,4 % |
Některá data mohou pocházet z datové položky. | |
Vinylacetát (systematický název ethenyl-ethanoát) je organická sloučenina, která se používá na výrobu polyvinylacetátu.
Výroba
Hlavním způsobem průmyslové výroby vinylacetátu je reakce ethenu s kyselinou octovou a kyslíkem za přítomnosti palladia jako katalyzátoru:
- C2H4 + CH3CO2H + 1/2 O2 → CH3CO2CHCH2 + H2O
Dříve se vyráběl adicí plynné kyseliny octové na acetylen za přítomnosti kovového katalyzátoru. Tímto způsobem jej, s použitím rtuťnaté soli jako katalyzátoru, roku 1912 připravil Fritz Klatte.[2] Další možný postup spočívá v tepelném rozkladu ethylidendiacetátu:
- (CH3CO2)2CHCH3 → CH3CO2CHCH2 + CH3COOH
Polymerace
Vinylacetát může být polymerizován za vzniku polyvinylacetátu (PVA). Lze jej také v kombinaci s dalšími monomery použít na výrobu kopolymerů jako jsou ethylenvinylacetát (EVA), polyvinylchloridacetát (PVCA) a polyvinylpyrrolidon.[3]
Ostatní reakce
U vinylacetátu probíhá mnoho reakcí, které lze očekávat u alkenu nebo esteru. Adicí bromu vzniká 1,2-dibromvinylacetát. S halogenovodíky vinylacetát reaguje za vzniku 1-haloethylacetátů, které nelzte připravit jinými způsoby, protože neexistují odpovídající halogenalkoholy. S kyselinou octovou za přítomnosti palladiového katalyzátoru vytváří ethylidendiacetát (CH3CH(OAc)2). Transesterifikací lze z vinylacetátu získat mnoho karboxylových kyselin.[4] U této látky rovněž probíhají Dielsova–Alderova reakce a 2+2 cykloadice.
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Vinylacetát na Wikimedia Commons
Obrázky, zvuky či videa k tématu Vinylacetát na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Vinyl acetate na anglické Wikipedii.
- ↑ a b Vinyl acetate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ G. Roscher "Vinyl Esters" in Ullmann's Encyclopedia of Chemical Technology, 2007 John Wiley & Sons: New York
- ↑ VP/VA Copolymer [online]. Personal Care Products Council [cit. 2012-12-13]. Dostupné v archivu pořízeném dne 2012-10-16. (anglicky)
- ↑ D. Swern; E. F. JORDAN, JR. Vinyl Laurate and Other Vinyl Esters. Organic Syntheses, Collected Volume 4. 1963, s. 977. Dostupné online [cit. 2017-10-28]. (anglicky) Archivovaná kopie. www.orgsyn.org [online]. [cit. 2017-10-28]. Dostupné v archivu pořízeném z originálu dne 2011-06-05.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Ball-and-stick model of the vinyl acetate molecule, C4H6O2.
Structure calculated using HF/6-31G* in Spartan '04 Student Edition.






