Vinylcyklopropanový přesmyk
Vinylcyklopropanový přesmyk je přesmyková reakce rozšiřující kruhy přeměňující cyklopropany s navázanými vinylovými skupinami na cyklopenteny.[1][2][3]
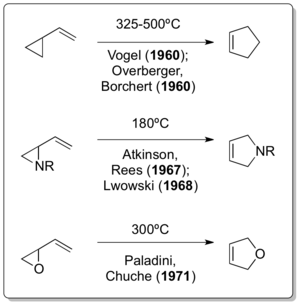
Rozšiřování kruhů cyklopropanů s vinylovými skupinami lze použít k tvorbě neobvyklých cyklických sloučenin, jako jsou cyklobuteny[4] a bicyklické cyklohepteny.[5]

Vinylcyklopropanové přesmyky mohou probíhat jako dvoukrokové reakce řízené diradikály a/nebo pericyklicky za řízení symetrií orbitalů. Podíl každého z mechanismů závisí na použitém substrátu.
Historie
V roce 1959 byl chemik Norman P. Neureiter pověřen úkolem najít využití pro butadien vznikající při rafinování ropy. Diskuse ohledně chemie karbenů jej přivedly k výzkumu reakcí využívajících jak karbeny, tak i butadien;[6] zabýval se především reakcemi buta-1,3-dienu s karbeny vytvořenými působením zásad na chloroform nebo bromoform.[7] Vzniklý 1,1-dichlor-2,2-dimethylcyklopropan poté pyrolyzoval (za teploty nad 400 °C) a objevil přesmyk 4,4-dichlorcyklopentenu, považovaný později za první známý tepelný přesmyk vinylcyklopropanu na cyklopenten.[8]

Nezávisle na tomto výzkumu byly o rok později popsány obdobné reakce využívající reaktanty s čistě uhlíkatými hlavními řetězci.[9][10][11]
Výzkum dalších vinylcyklopropanových přesmyků pokračoval rychle.[12][13][14]
„Běžné“ vinylcyklopropanové přesmyky byly objeveny až po dvou heteroatomových podobách. Přestože se předpokládalo, že vinylcyklopropanový přesmyk proběhl i v rámci Demjanovovy přípravy vinylcyklopropanu Hofmannovou eliminací za vysokých teplot, provedenou roku 1922,[15] tak jsou jedinými potvrzenými přesmyky vinylcyklopropanového typu, do kterých se zapojují heteroatomy, Clokeův cyklopropylimin-pyrrolinový přesmyk z roku 1929[16] a Wilsonův cyklopropankarbaldehyd-2,3-dihydrofuranový přesmyk (1947).[17]
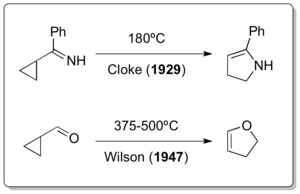
Poslední z těchto reakcí bývá také nazývána Clokeovým–Wilsonovým přesmykem[18]
Mechanismus
Diskuse o tom, jestli vinylcyklopropanové přesmyky probíhají jako diradikálové dvoukrokové reakce, nebo jako soustředěné reakce řízené symetrií orbitalů, trvají přes 50 let. Kinetická data společně se sekundárními kinetickými izotopovými efekty na vinylových koncích vinylcyklopropanů naznačují soustředěný mechanismus, zatímco rozdělení produktů odpovídá postupnému diradikálovému mechanismu.[19]
V 60. letech, krátce po objevu tohoto přesmyku, bylo zjištěno, že aktivační energie vinylcyklopropanových přesmyků bývá okolo 210 kJ/mol.[20]
Získaná kinetická data odpovídala soustředěnému mechanismu, přičemž krokem určujícím rychlost bylo štěpení vazby uhlík-uhlík v cyklopropylové skupině. Přestože se jako pravděpodobný jevil soustředěný mechanismus, tak bylo brzy zjištěno, že aktivační energie pro rozdělení vazby uhlík-uhlík u nesubstituovaného cyklopropanu je 260 kJ/mol,[21] o 50 kJ/mol vyšší; rozdíl se nápadně podobal rezonanční energii allylového radikálu.[22] Na základě těchto zjištění se začalo uvažovat o diradikálovém meziproduktu vznikajícím tepelnou homolýzou slabé vazby C1-C2 u cyklopropanu.

Do sporů o mechanismus vinylcyklopropanových přesmyků se přidal v roce 1969 Woodwardův a Hoffmannův pokus vysvětlit [1,3]-sigmatropní přesmyky pomocí vinylcyklopropanových přesmyků.[23] Předpokládali, že jestliže tento přesmyk probíhá soustředěným mechanismem, tak vlivy symetrie orbitalů umožní tvorbu pouze některých produktů. Na základě analýzy vinylcyklopropanů substituovaných třemi skupinami R jsou symetricky povolené antarafaciální [1,3]-přesmyky vazeb 1,2 na C5, se zachováním na C-2, za vzniku ar-cyklopentenů, a suprafaciální [1,3]-přesmyky vazeb 1,2 na C5, s inverzí na C2, vytvářející si-cyklopenteny a suprafaciální [1,3]-přesmyky vazeb 1,2 na C5, se zachováním na C2, vedoucí k sr-cyklopentenům, a antarafaciální [1,3]-přesmyky vazeb 1,2 na C5, s inverzí na C2, vedoucí k ai-cyklopentenům jsou symetrií zakázané.
Woodwardova a Hoffmannova analýza byla založena pouze na zachovávání symetrie orbitalů a nevytvářela žádné předpovědi mechanismu ani stereochemie.

Woodwardův a Hoffmannův výzkum vinylcyklopropanových přesmyků, zaměřený na [1,3]-uhlíkové přesmyky, zvětšil zájem o zkoumání těchto reakcí. Jejich analýzy poskytly možnosti provést experimenty, které mohou být použity k rozhodnutí mezi soustředěným nebo postupným mechanismem. Obecné stereochemické vlastnosti soustředěných reakcí vedly k navržení experimentu, kde by bylo možné porovnat stereochemická data skutečné reakce s předpovězenými pro daný modelový substrát. Pozorování ai- a sr-cyklopentenových produktů by podporovalo postupný mechanismus a jejich nepřítomnost plně soustředěný; nalezení vhodně substituovaného modelového substrátu se ale ukázalo jako velmi obtížné, protože stereochemii produktů mohou výrazně narušit vedlejší reakce, jako jsou homodienylové [1,5]-přesuny vodíků a stereomutace.

I přes obtížné zkoumání kinetiky vinylcyklopropanových přesmyků bylo vydáno několik studií poskytujících přesná kinetická a stereochemická výchozí data pro započítání stereomutací do výzkumu mechanismu.[19][24][25][26]
Lze tedy určit rychlostní konstanty všech čtyř možných průběhů reakce.

Úpravy
Největším syntetickým nedostatkem vinylcyklopropanových přesmyků je vysoká aktivační energie, která vytváří potřebu provádění reakcí za vysokých teplot (500-600 °C). Vysoké teploty vedou k vedlejším reakcím s podobnými aktivačními energiemi, jako jsou homodienyl-[1,5]-vodíkové přesuny, a také omezují rozsah použitelných funkčních skupin na substrátech. Potřebnou teplotu lze výrazně snížit navázáním dithianové skupiny na cyklopropanový kruh; přestože dithianové vinylcyklopropany vyžadují na přípravu z odpovídajících 1,3-dienů dva syntetické kroky, tak se tento postup ukázal jako vhodný na přípravy mnoha různých cyklopentenů. Produkty přesmyků takto substituovaných substrátů lze snadno převést na cyklopentenony.[27]

Methoxyované vinylcyklopropany reagují výrazně rychleji, což umožňuje provádět reakce při 220 °C.[28]

Silyloxyvinylcyklopropany[29] a sulfinylvinylcyklopropany[30] lze použít na přípravu anelovaných cyklopentenů. I když tyto reakce stále vyžadují teploty nad 300 °C, tak mohou být užitečnými meziprodukty díky zavedení cyklopentenových skupin na již existující kruhy.

Vinylcyklopropanové přesmyky mohou být řízeny i fotochemicky.[31][32]
Vinylcyklopropanové struktury zabudované do cyklooktanových kruhů je možné přeměnit na [5-5]-spojené kruhy.

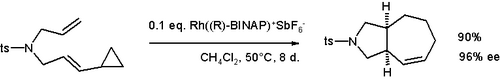
Octan rhodnatý může katalyzovat vinylcyklopropanové přesmyky za teplot pod 80 °C.[33][34]

Obdobné urychlení reakce jako u aniontového a oxy-Copeova přesmyku se objevuje u vinylcyklopropanů obsahujících alkoxy skupiny.[35]

Přesmyky některých vinylcyklopropanů lze uskutečnit i při -78 °C; substráty pro takovéto přesmyky se připravují in situ zmenšováním kruhů thiokarbonylových Dielsových-Alderových aduktů v zásaditých prostředích. Uvedeným způsobem lze stereoselektivně vytvářet vysoce funkcionalizované cyklopenteny;[36]

tento postup je možné využít na přípravu [5-5]- a [5-6]-uhlíkových řetězců.[37]

Využití v totálních syntézách
Pětiuhlíkaté kruhy se vyskytují v mnoha přírodních látkách. Neexistuje ekvivalent Dielsovy-Alderovy reakce pro tvorbu pětičlenných kruhů, ale s objevem vinylcyklopropanového přesmyku okolo roku 1960 se vynořil postup, jak připravovat i takovéto sloučeniny. Po vylepšení vinylcyklopropanových přesmyků v 70 letech byly tyto reakce zahrnuty kolem roku 1980 do prvních totálních syntéz, které provedli Barry Trost, Elias James Corey, Thomas Hudlicky, a Leo Paquette.
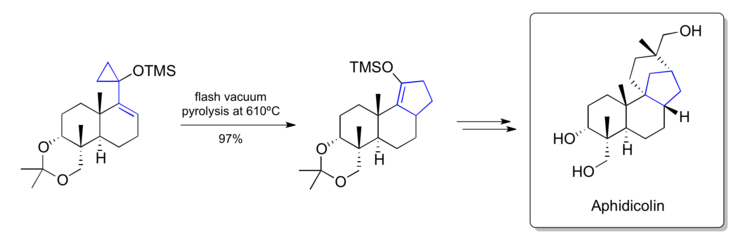
Trostova syntéza afidikolinu (1979)
K syntéze afidikolinu použil Barry Trost metodu pro reakce vinylcyklopropanů. kterou vyvinul ve vlastní laboratoři.[38]
Vinylcyklopropanový přesmyk posloužil k převedení silyloxyvinylcyklopropanu na cyklopenten obsahující [6-6-5]-propojený uhlíkatý řetězec; několik dalších přeměn vedlo ke konečnému produktu.
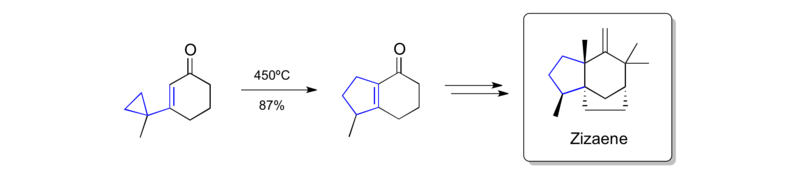
Piersova syntéza zizaenu (1979)
Vinylcyklopropanový přesmyk je také součástí Piersovy syntéza zizaenu, z roku 1979.[39]
Hudlického syntéza hirsutenu (1980) a isokomenu (1984)
Vinylcyklopropanový přesmyk byl také zahrnut do příprav hirsutenu[40] a isokomenu.[41]

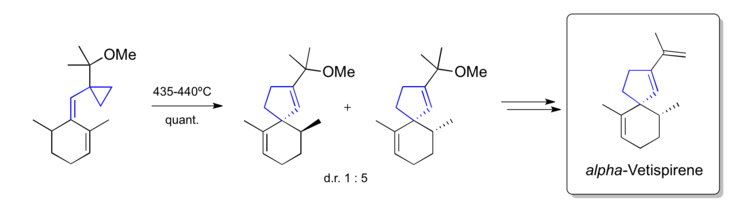
Příprava alfa-vetispirenu
Vinylcyklopropanový přesmyk lze použít též jako součást přípravy spirocyklické přírodní látky alfa-vetispirenu.[42]
Syntéza anteridiogenu-an
V závěrečné části totální syntézy anteridiogenu-an byl použit vinylcyklopropanový přesmyk řízený Lewisovou kyselinou.[43]

Příprava biotinu
Tetrahydrothiofenové jádro biotinu a thiofenové jádro klopidogrelu lze vytvořit pomocí heteroatomových vinylcyklopropanových přesmyků katalyzovaných mědí.[44]

Příprava salviasperanolu
Kysele katalyzovaný vinylcyklopropanový přesmyk byl zahrnut do přípravy salviasperanolu.[45]

Odkazy
Reference
V tomto článku byl použit překlad textu z článku Vinylcyclopropane rearrangement na anglické Wikipedii.
- ↑ E. M. Mil'vitskaya; A. V. Tarakanova; Alfred F. Plate. Thermal Rearrangements of Vinylcyclopropanes. Russian Chemical Reviews. 1976, s. 469–478. doi:10.1070/RC1976v045n05ABEH002675. Bibcode 1976RuCRv..45..469M.
- ↑ Z. Goldschmidt; B. Crammer. Vinylcyclopropane rearrangements. Chemical Society Reviews. 1988, s. 229–267. doi:10.1039/CS9881700229.
- ↑ Tomas Hudlicky; Josephine W. Reed. From Discovery to Application: 50 Years of the Vinylcyclopropane-Cyclopentene Rearrangement and Its Impact on the Synthesis of Natural Products. Angewandte Chemie International Edition. 2010, s. 4864–4876. doi:10.1002/anie.200906001. PMID 20586104.
- ↑ Alois Fürstner; Christophe Aïssa. PtCl-Catalyzed Rearrangement of Methylenecyclopropanes. Journal of the American Chemical Society. 2006, s. 6306–6307. doi:10.1021/ja061392y. PMID 16683781.
- ↑ Paul A. Wender; Lars O. Haustedt; Jaehong Lim; Jennifer A. Love; Travis J. Williams; Joo-Yong Yoon. Asymmetric Catalysis of the [5 + 2] Cycloaddition Reaction of Vinylcyclopropanes and π-Systems. Journal of the American Chemical Society. 2006, s. 6302–6303. doi:10.1021/ja058590u. PMID 16683779.
- ↑ Robert C. Woodworth; Philip S. Skell. Reactions of bivalent carbon species. Addition of dihalocarbenes to 1,3-butadiene. Journal of the American Chemical Society. 1957, s. 2542. doi:10.1021/ja01567a048.
- ↑ W. von E. Doering; A. Kentaro Hoffman. The Addition of Dichlorocarbene to Olefins. Journal of the American Chemical Society. 1954, s. 6162. doi:10.1021/ja01652a087.
- ↑ Norman Neureiter. Pyrolysis of 1,l-Dichloro-2-vinylcyclopropane. Synthesis of 2-Chlorocyclopentadiene. The Journal of Organic Chemistry. 1959, s. 2044. doi:10.1021/jo01094a621.
- ↑ Emanuel Vogel. Kleine Kohlenstoff-Ringe. Angewandte Chemie. 1960, s. 4–26. doi:10.1002/ange.19600720103. Bibcode 1960AngCh..72....4V.
- ↑ C. G. Overberger; A. E. Borchert. Novel thermal rearrangements accompanying acetate pyrolysis in small ring systems. Journal of the American Chemical Society. 1960, s. 1007. doi:10.1021/ja01489a069.
- ↑ C. G. Overberger; A. E. Borchert. Ionic Polymerization. XVI. Reactions of 1-Cyclopropylethanol-Vinylcyclopropane. Journal of the American Chemical Society. 1960, s. 4896. doi:10.1021/ja01503a036.
- ↑ R. S. Atkinson; C. W. Rees. A vinylaziridine to pyrroline rearrangement. Chemical Communications. 1967, s. 1232a. doi:10.1039/C1967001232a.
- ↑ Walter Lwowski; Susan N. Rice. Singlet and Triplet Nitrenes. 111. The Addition of Carbethoxynitrene to 1,3-Dienes. The Journal of Organic Chemistry. 1968, s. 481. doi:10.1021/jo01266a001.
- ↑ J. Paladini; X. X. Chuche. Rearrangement thermique d'epoxydes vinyliques. Tetrahedron Letters. 1971, s. 4383. doi:10.1016/S0040-4039(01)97447-7.
- ↑ N. J. Demjanow; Marie Dojarenko. Über Vinylcyclopropan, einige Derivate des Methyl-cyclopropyl-carbinols und die Isomerisation des Cyclopropan-Ringes. Berichte der Deutschen Chemischen Gesellschaft, B: Abhandlungen. 1922, s. 2718. Dostupné online. doi:10.1002/cber.19220550846.
- ↑ J. B. Cloke; A. E. Borchert. The formation of pyrrolines from gamma-chloropropyl and cyclopropyl ketimines. Journal of the American Chemical Society. 1929, s. 1174. doi:10.1021/ja01379a028.
- ↑ C. L. Wilson; A. E. Borchert. Reactions of Furan Compounds. VII. Thermal Interconversion of 2,3-Dihydrofuran and Cyclopropane Aldehyde. Journal of the American Chemical Society. 1947, s. 3002. doi:10.1021/ja01204a020.
- ↑ Organic Syntheses Based on Name Reactions: A Practical Guide to 750 Transformations Alfred Hassner, Irishi Namboothiri Elsevier, 2012
- ↑ a b John E. Baldwin. Thermal Rearrangements of Vinylcyclopropanes to Cyclopentenes. Chemical Reviews. 2003, s. 1197–1212. doi:10.1021/cr010020z. PMID 12683781.
- ↑ M. C. Flowers; B. S. Rabinovitch. The Thermal Unimolecular Isomerisation of Vinylcyclo- propane to Cyclopentene. Journal of the Chemical Society. 1960, s. 3547. doi:10.1021/ja01508a008.
- ↑ E. W. Schlag; B. S. Rabinovitch. Kinetics of the Thermal Unimolecular Isomerization Reactions of Cyclopropane-d2. Journal of the American Chemical Society. 1960, s. 5996. doi:10.1021/ja01508a008.
- ↑ K. W. Egger; David M. Golden; Sidney W. Benson. Iodine-Catalyzed Isomerization of Olefins. 11. The Resonance Energy of the Allyl Radical and the Kinetics of the Positional Isomerization of 1-Butene. Journal of the American Chemical Society. 1964, s. 5420. doi:10.1021/ja01078a011.
- ↑ R. B. Woodward; R. Hoffmann. The Conservation of Orbital Symmetry. Angewandte Chemie International Edition. 1969, s. 781. doi:10.1002/anie.196907811.
- ↑ Joseph J. Gajewski; Michael P. Squicciarini. Evidence for concert in the vinylcyclopropane rearrangement. A reinvestigation of the pyrolysis of trans-1-methyl-2-(1-tert-butylethenyl)cyclopropane. Journal of the American Chemical Society. 1989, s. 6717. doi:10.1021/ja00199a035.
- ↑ Joseph J. Gajewski; Michael P. Squicciarini. Evidence for a dominant suprafacial-inversion pathway in the thermal unimolecular vinylcyclopropane to cyclopentene 1,3-sigmatropic shift. Journal of the American Chemical Society. 1991, s. 7432. doi:10.1021/ja00019a056.
- ↑ Joseph J. Gajewski; Michael P. Squicciarini; M. Robert Willcott. Evidence for Concert in the Thermal Unimolecular Vinylcyclopropane to Cyclopentene Sigmatropic 1,3-Shift. Journal of the American Chemical Society. 1996, s. 299. doi:10.1021/ja951578p.
- ↑ E. J. Corey; S. W. Walinsky. Reaction of 1,3-dithienium fluoroborate with 1,3-dienes. Synthesis of .DELTA.3-cyclopenten-1-ones. Journal of the American Chemical Society. 1972, s. 8932. doi:10.1021/ja00780a063.
- ↑ John M. Simpson; Herman G. Richey. The effects of methoxyl and phenyl substituents on the thermal rearrangements of vinylcyclopropane. Tetrahedron Letters. 1973, s. 2545. doi:10.1016/S0040-4039(01)96201-X.
- ↑ Barry M. Trost; Mitchell J. Bogdanowicz. New synthetic reactions. IX. Facile synthesis of oxaspiropentanes, versatile synthetic intermediates. Journal of the American Chemical Society. 1973, s. 5311. doi:10.1021/ja00797a036.
- ↑ Barry M. Trost; Donald E. Keeley. New synthetic methods. A stereocontrolled approach to cyclopentane annelation. Journal of the American Chemical Society. 1976, s. 248–250. doi:10.1021/ja00417a048.
- ↑ Leo A. Paquette; George V. Meehan; Richard P. Henzel; Richard F. Eizember. Photochemistry of conjugated cis-bicyclo[5.1.0]octenones, cis- and trans-bicyclo[5.2.0]non-2-en-4-ones, and their methylene analogs. The Journal of Organic Chemistry. 1973, s. 3250. doi:10.1021/jo00959a004.
- ↑ Leo A. Paquette; Richard P. Henzel. Thermochemical behavior of conjugated cis-bicyclo[5.1.0]octenones, cis- and trans-bicyclo[5.2.0]non-2-en-4-ones, and their methylene analogs. The Journal of Organic Chemistry. 1973, s. 3257. doi:10.1021/jo00959a005.
- ↑ Tomas Hudlicky; Francis F. Koszyk; Toni M. Kutchan; Jagdish P. Sheth. Cyclopentene annulation via intramolecular addition of diazoketones to 1,3-dienes. Applications to the synthesis of cyclopentanoid terpenes. The Journal of Organic Chemistry. 1980, s. 5020. doi:10.1021/jo01313a003.
- ↑ Vanessa Brown; John M. Brown; John A. Conneely; Bernard T. Golding; David H. Williamson. Synthesis and thermolysis of rhodium and iridium complexes of endo-6-vinylbicyclo[3.1.0]hex-2-ene. A metal-promoted vinylcyclopropane to cyclopentene rearrangement. Journal of the Chemical Society, Perkin Transactions 2. 1975, s. 4. doi:10.1039/P29750000004.
- ↑ Rick L. Danheiser; Carlos Martinez-Davila; John M. Morin. Synthesis of 3-cyclopentenols by alkoxy-accelerated vinylcyclopropane rearrangement. The Journal of Organic Chemistry. 1980, s. 1340. doi:10.1021/jo01295a045.
- ↑ Scott D. Larsen. A stereoselective synthesis of functionalized cyclopentenes via base-induced ring contraction of thiocarbonyl Diels-Alder adducts. Journal of the American Chemical Society. 1988, s. 5932–5934. doi:10.1021/ja00225a072.
- ↑ Tomas Hudlicky; Nina E. Heard; Alison Fleming. 4-Siloxy-.alpha.-bromocrotonate: A new reagent for [2+3] annulation leading to oxygenated cyclopentenes at low temperatures. The Journal of Organic Chemistry. 1990, s. 2570. doi:10.1021/jo00296a004.
- ↑ B. M. Trost; Yoshio Nishimura; Kagetoshi Yamamoto. A Total Synthesis of Aphidicolin. Journal of the American Chemical Society. 1979, s. 1328. doi:10.1021/ja00499a071.
- ↑ E. Piers. Five-membered Ring Annelation via Thermal Rearrangement of a-Cyclopropyl-ab-unsaturated Ketones: a New Total Synthesis of (&)-Zizaene. Journal of the Chemical Society, Chemical Communications. 1979, s. 1138. doi:10.1039/C39790001138.
- ↑ T. Hudlicky; Toni M. Kutchan; Stephen R. Wilson; David T. Mao. Total Synthesis of (rac)-Hirsutene. Journal of the American Chemical Society. 1980, s. 6351. doi:10.1039/C39790001138.
- ↑ T. Hudlicky; Misha Kavka; Leslie A. Higgs. Stereocontrolled Total Synthesis of Isocomene Sesquiterpenes. Tetrahedron Letters. 1984, s. 2447. doi:10.1016/S0040-4039(01)81201-6.
- ↑ L. A. Paquette. A Short Synthesis of (rac)-alpha-Vetispirene. Tetrahedron Letters. 1982, s. 3227. doi:10.1016/s0040-4039(00)87576-0.
- ↑ E. J. Corey; Andrew G. Myers. Total Synthesis of (rac)-Antheridium-Inducing Factor (AAn,2) of the Fern Anemia pbylfitidis. Clarification of Stereochemistry. Journal of the American Chemical Society. 1985, s. 5574. doi:10.1021/ja00305a067.
- ↑ J. T. Njardarson; H. Araki; L. A. Batory; C. E. McInnis. Highly Selective Copper-Catalyzed Ring Expansion of Vinyl Thiiranes: Application to Synthesis of Biotin and the Heterocyclic Core of Plavix. Journal of the American Chemical Society. 2007, s. 2768–2769. doi:10.1021/ja069059h. PMID 17302422.
- ↑ G. Majetich; G. Zou; J. Grove. Total Synthesis of (−)-Salviasperanol. Organic Letters. 2008, s. 85–87. doi:10.1021/ol701743c. PMID 18052176.
Související články
- Skattebølův přesmyk
- Di-π-methanový přesmyk
- Divinylcyklopropan-cykloheptadienový přesmyk
Média použitá na této stránce
Autor: A.R.Roetheli, Licence: CC BY-SA 3.0
MechanisticDevelopment_Larsen
Autor: A.R.Roetheli, Licence: CC BY-SA 3.0
MechanisticDevelopment_Brown&Hudlicky
Autor: A.R.Roetheli, Licence: CC BY-SA 3.0
VinylcyclopropaneRearrangement Header 1
Autor: A.R.Roetheli, Licence: CC BY-SA 3.0
MechanisticDevelopment_Hudlicky
Autor: A.R.Roetheli, Licence: CC BY-SA 3.0
MechanisticDevelopment_Trost
Autor: A.R.Roetheli, Licence: CC BY-SA 3.0
MechanisticDevelopment_Danheiser
Autor: A.R.Roetheli, Licence: CC BY-SA 3.0
MechanisticDevelopment_Corey
Autor: A.R.Roetheli, Licence: CC BY-SA 3.0
6 Njardarson Biotin&Plavix
Autor: A.R.Roetheli, Licence: CC BY-SA 3.0
MechanisticDevelopment_Simpson
Autor: A.R.Roetheli, Licence: CC BY-SA 3.0
MechanisticDevelopment_Paquette