Vodíková vazba
Vodíková vazba (také vodíkový můstek) je typ intermolekulární nebo intramolekulární interakce, k níž dochází sdílením vodíkových atomů. Může se uplatnit mezi molekulami, ale i v rámci dvou částí jedné molekuly.
Vodíková vazba patří mezi tři základní chemické vazby, které jsou považovány za biologicky důležité. Jsou to iontové vazby, kovalentní vazby a vodíkové vazby. Je podstatně slabší než iontová nebo kovalentní vazba, ale silnější než většina ostatních mezimolekulových interakcí.
Vodíková vazba je běžný typ chemické vazby v organismech. Může se vyskytovat v anorganických molekulách (například voda), ale i v organických molekulách (například nukleové kyseliny a proteiny). Vodíková vazba je zodpovědná za tvorbu sekundárních a terciárních struktur nukleových kyselin a proteinů.
Historie
První zmínku o vodíkové vazbě v roce 1912 připisuje Linus Pauling dvěma vědcům T. S. Moorovi a T. F. Winmillovi, kteří použili termín vodíková vazba k vysvětlení skutečnosti, že hydroxid trimethylamonný je slabší zásadou než hydroxid tetramethylamonný.
O několik let později v roce 1920 popsali Wendell Mitchell Latimer a Worth H. Rodebush vodíkové vazby ve vodě. Ve svém vědeckém článku citují práci kolegy, vědce z jejich laboratoře, Maurice Loyala Hugginse:
"Pan Huggins použil myšlenku vodíkového jádra drženého mezi dvěma atomy jako teorii týkající se určitých organických sloučenin."
Vznik vodíkové vazby
Pro vznik vodíkové vazby musí být splněny dvě základní podmínky:
- Atom vodíku musí být vázán na vysoce elektronegativní atom. Čím větší je elektronegativita tohoto atomu, tím silnější je polarizace. Vodík vázaný na kyslík je tak schopnější vytvořit vodíkovou vazbu než vodík vázaný na uhlík.
- Elektronegativní atom musí být malý. Čím menší je atom, tím větší je jeho elektrostatická přitažlivost. Menší fluor je tedy při vytváření vodíkových vazeb vhodnější než větší jód.
Atom vodíku má pouze jeden elektron, a proto při vytvoření vazby s elektronegativním prvkem dojde ke značnému odhalení jeho atomového jádra, tedy kladně nabitého protonu. Vzniklý parciální kladný náboj na atomu vodíku může poutat nevazebné elektronové páry okolních molekul (intermolekulární vazba) nebo stejné molekuly (intramolekulární vazba). Takovými molekulami jsou výrazně elektronegativní prvky fluor, kyslík a dusík. Jedině tyto tři prvky jsou schopné v dostatečné míře odčerpat elektron od atomu vodíku.
Vznik vodíkové vazby je vysvětlován elektrostatickými a kvantově-mechanickými interakcemi. Z elektrostatických je to hlavně interakce dipól-dipól a Londonovy disperzní síly.
Popis vodíkové vazby

Vodíkovou vazbu lze popsat vzorcem A–Hδ+∙∙∙B,
- atom A je silně elektronegativní prvek (například fluor, kyslík nebo dusík)[1]
- vodík Hδ+ s parciálním kladným nábojem
- atom B je prvek s volným elektronovým párem (například opět fluor, kyslík nebo dusík)
- normální vazba je znázorněna plnou čárou a vodíková vazba tečkovanou čárou.
Vysoká elektronegativita atomu A způsobí posun elektronů směrem k A, takže na atomu H vzniká částečný kladný náboj, který přitahuje záporný náboj volného elektronového páru atomu B.
Ve vodíkové vazbě se rozlišuje mezi donorem protonu a akceptorem protonu. Donor A je elektronegativní atom, na který je atom vodíku kovalentně vázán. Akceptor je jakýkoliv jiný atom s volnými elektronovými páry. Vazba atomu vodíku k donoru je silnější a je znázorněna plnou čarou. Vazba k akceptoru je obvykle slabší a je symbolizována tečkovanou čárou.
Energie vodíkové vazby
Vodíková vazba je slabý typ chemické vazby, ve srovnání s kovalentními a iontovými vazbami je přibližně desetkrát slabší. Nicméně je poněkud silnější než interakce van der Waalsova. Délka vodíkové vazby závisí na energii vazby, teplotě a tlaku. George A. Jeffrey zavedl klasifikaci pevnosti vodíkových vazeb:
- Silné vazby 63-167 kJ/mol, například vodíková vazba ve fluorovodíku (161,5 kJ/mol u aniontu HF2−)
- Střední vazby 17-63 kJ/mol, například vodíkové vazby ve vodě (H2O) nebo sacharidech
- Slabé vazby < 17 kJ/mol, například vodíkové vazby v proteinech
Typická délka vodíkové vazby ve vodě je 1,97 Å a je tvořena klasickým atomem vodíku (izotop vodíku protium). Pokud se vodík váže na těžkou vodu (izotop vodíku deuterium), jsou vodíkové vazby ještě silnější než ty s normální vodou. Vodíkové vazby zahrnující tritiovanou vodu (izotop vodíku tritium) jsou ještě silnější.
Druhy vodíkových vazeb
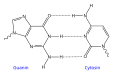
- Intramolekulární vodíkové vazby jsou vazby uvnitř jedné molekuly, ve které jsou funkční skupiny uspořádány tak, že mezi nimi vznikají vzájemné přitažlivé síly. Intramolekulární vodíková vazba je například v proteinech a nukleových kyselinách. Například DNA má dvojitou spirálovitou strukturu, která je z velké části způsobena vodíkovými vazbami mezi párovými dusíkatými bázemi.
- Intermolekulární vodíkové vazby jsou vazby mezi atomy dvou různých molekul. Dochází k nim, pokud jedna molekula obsahuje částečně pozitivní atom vodíku a druhá molekula obsahuje částečně negativní atom. Například mezi polarizovanými molekulami vody dochází k tomu, že elektronegativní vodík jedné molekuly vody je elektrostaticky přitahován k elektropozitivnímu atomu kyslíku blízké molekuly vody. Vodíková vazba pak ve vodě způsobuje vysoký bod varu (100 °C), vysoké povrchové napětí, specifické teplo a teplo odpařování.
- Intramolekulární a intermolekulární vodíkové vazby se mohou vyskytovat současně. Dochází k nim v biologických strukturách. Například vlákno celulózy může mít vodíkové vazby uvnitř molekul celulózy a také mezi nimi.
Výskyt vodíkové vazby
Vodíkové vazby existují v anorganických sloučeninách jako je voda a v různých organických sloučeninách. V biomolekulách jako jsou nukleové kyseliny nebo bílkoviny jsou zodpovědné za sekundární a terciární struktury. Strukturální úlohu mají i při tvorbě polymerů, jak syntetických (například nylon), tak přírodních (například celulóza). Příklady vodíkových vazeb:
- Kyselina fluorovodíková (HF) tvoří takzvanou symetrickou vodíkovou vazbu, kde je proton umístěn v polovině cesty mezi dvěma identickými atomy. Symetrická vodíková vazba je silnější než běžná vodíková vazba.
- Amoniak (NH3) vytváří mezimolekulární vodíkové vazby mezi vodíkem jedné molekuly a dusíkem druhé. V případě amoniaku je vytvořená vazba velmi slabá, protože každý dusík má jeden osamocený elektronový pár.
- Acetylaceton (C5H8O2) vytváří intramolekulární vodíkové vazby mezi vodíkem a kyslíkem.
- Ethanol a další alkoholy obsahují vodíkové vazby mezi vodíkem a kyslíkem.
- Chloroform (CHCl3) vytváří vodíkovou vazbu mezi vodíkem jedné molekuly a chlorem jiné molekuly.
- DNA - vodíkové vazby vznikají mezi páry dusíkatých bází. To dává DNA tvar dvojité šroubovice a umožňuje replikaci vláken.
- Bílkoviny - intramolekulární vodíkové vazby vedou ke skládání bílkovin do terciárních struktur, což molekule pomáhá udržovat stabilitu a funkční konfiguraci.
- Nylon - vodíkové vazby se nacházejí mezi opakujícími se jednotkami polymeru.
- Polymery, které obsahují karbonylové nebo amidové skupiny, tvoří vodíkové vazby. Vodíkové vazby v těchto molekulách zvyšují jejich pevnost v tahu a teplotu tání. Patří mezi ně polyurethany a přírodní polymerní celulóza.
Vliv vodíkových vazeb
- Bod tání a varu - látky s podobnou molekulovou hmotností mají obvykle podobné teploty tání a varu. Vodíková vazba zvyšuje bod tání a varu, protože k rozbití vodíkových vazeb je třeba další energie. Alkoholy, které obsahují vodíkové vazby, tak mají mnohem vyšší teploty varu než ethery srovnatelné molekulové hmotnosti.
- Rozpustnost - vodíková vazba zvyšuje rozpustnost látek ve vodě, neboť umožňuje vytvářet vodíkové vazby s vodou. Například alkoholy jsou rozpustné ve vodě, ale alkany nikoli. Umožňují to mezimolekulární vodíkové vazby v alkoholech, které nepolární alkany nemohou vytvářet. Zvětšení délky uhlíkového řetězce v alkoholech však snižuje jejich rozpustnost, protože řetězec brání tvorbě vodíkových vazeb.
- Viskozita a povrchové napětí - vodíková vazba snižuje schopnost molekul proudit, takže takové látky mají vyšší viskozitu a povrchové napětí.
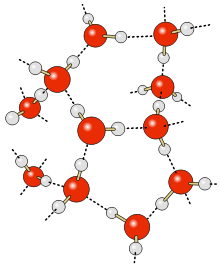
- Nižší hustota ledu než vody - vodíkové vazby vytvářejí v ledu strukturu podobnou kleci. Kapalná voda nemá tak těsnou strukturu, a proto má led nižší hustotu než voda a plave na ní.
Vodíkové vazby ve vodě
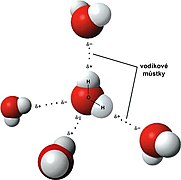
V molekule vody H2O jsou dva atomy vodíku a jeden atom kyslíku. Nejjednodušším případem je dvojice molekul vody s jednou vodíkovou vazbou mezi nimi, která se nazývá vodní dimer a často se používá jako modelový vzor.
Pokud je přítomno více molekul, jako je tomu v případě kapalné vody, je možné více vazeb. Kyslík jedné molekuly vody má dva volné páry elektronů, z nichž každý může tvořit vodíkovou vazbu s vodíkem na jiné molekule vody. To se může opakovat tak, že každá molekula vody je vázána až se čtyřmi dalšími molekulami.

Vodíkové vazby silně ovlivňují krystalovou strukturu ledu a pomáhají vytvářet otevřenou hexagonální mřížku. To způsobuje, že při stejné teplotě je hustota ledu menší než hustota kapalné vody. Na rozdíl od většiny ostatních látek tak pevná fáze vody plave na kapalné fázi.
Vzhledem k obtížnosti rozbití vodíkových vazeb má voda velmi vysoký bod varu, bod tání a viskozitu ve srovnání s podobnými kapalinami, které neobsahují vodíkové vazby.
Vodíkové vazby v makromolekulách
V makromolekulách má vodíková vazba velký vliv na jejich strukturu. Způsobuje, že se makromolekula skládá do specifického tvaru, který pak hraje důležitou roli pro její fyziologické nebo biochemické vlastnosti.
- DNA - dvojitá šroubovicová struktura DNA je z velké části způsobena vodíkovými vazbami mezi páry dusíkatých bází, které spojují jedno komplementární vlákno s druhým.
- Proteiny - vodíkové vazby mezi páteřními kyslíky a amidovými vodíky bílkovin hrají důležitou roli pro jejich sekundární a terciární strukturu. Mají tak vliv na vznik alfa šroubovice nebo beta listu.
- Celulóza - vodíkové vazby jsou důležité pro strukturu celulózy a odvozených polymerů (například bavlna nebo len).
- Syntetické polymery - mnoho syntetických polymerů obsahuje vodíkové vazby uvnitř a mezi řetězci (například nylon).
- Vodíkové vazby mezi dusíkatými bázemi guanin-cytosin v DNA
- Šroubovice DNA, kde důležitou roli hrají vodíkové můstky
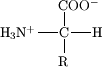
- Obecný vzorec aminokyselin, které jsou základem bílkovin
- Vodíkové vazby mezi aminokyselinami v bílkovině, zde struktura Beta-listu
Reference
V tomto článku byly použity překlady textů z článků Wasserstoffbrückenbindung na německé Wikipedii a Hydrogen bond na anglické Wikipedii.
- ↑ Vodíková vazba (vodíkový můstek) [online]. Vysoká škola chemicko-technologická [cit. 2012-09-07]. Dostupné online.
Externí odkazy
 Obrázky, zvuky či videa k tématu vodíková vazba na Wikimedia Commons
Obrázky, zvuky či videa k tématu vodíková vazba na Wikimedia Commons
Média použitá na této stránce
Párování bází guanin – cytosin. Vodíkové můstky vyznačeny tečkovaně.
Autor:
- DNA_Structure+Key+Labelled.pn_NoBB.png: Zephyris
- derivative work: Vojtech.dostal (talk)
Struktura dvoušroubovice DNA: detailní struktura čtyř bází - adeninu (A), guaninu (G), cytosinu (C) a thyminu (T) a umístění velkého a malého žlábku.
Vodíkové můstky mezi molekulami vody v češtině.
Crystal structure of hexagonal ice (Ih)
Autor: User:Ppfk, Licence: CC BY-SA 3.0
Estrutura geral de um aminoácido
Autor: Roland.chem, Licence: CC0
Wasserstoffbrückenbindung zwischen zwei Wassermolekülen