Ylidy
Ylidy jsou neutrální dipolární molekuly obsahující záporně nabitý atom (obvykle karboanion) přímo navázaný na heteroatom s kladným nábojem (což je většinou dusík, fosfor nebo síra), v níž mají všechny atomy plné oktety elektronů. Vznikají tak struktury, kde jsou dva sousední atomy propojeny jak kovalentními, tak i iontovými vazbami; to se obvykle zapisuje X+–Y−. Ylidy jsou tak 1,2-dipolární sloučeniny a skupinou zwitteriontů.[1] Mají využití v organické chemii jako reaktanty a reaktivní meziprodukty.[2]
Rezonanční struktury
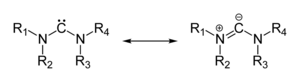
Mnoho ylidů lze popsat násobnou vazbou v rezonanční struktuře, nazývané ylenová forma, skutečná struktura se ovšem nachází mezi těmito formami:
Skutečné vazby v tomto druhu ylidů odpovídají zwitteriontu (struktuře vpravo) se silným coulombovským přitahováním mezi „oniovým“ atomem a sousedním uhlíkem, což způsobuje zkrácení vazby a také trigonální pyramidovou strukturu.
Fosfoniumylidy
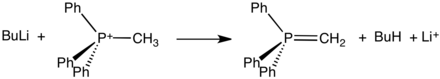
 Struktura methylentrifenylfosforanu
Struktura methylentrifenylfosforanu
Fosfoniumylidy se používají ve Wittigových reakcích, přeměňujících ketony a aldehydy na alkeny. Kladný náboj se u nich nachází na atomu fosforu se třemi fenylovými substituenty a vazbou na karboanion. Ylidy mohou být „stabilizované“ nebo „nestabilizované“.
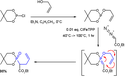
Obvykle se vytváří reakcí trifenylfosfinu s alkylhalogenidy, přičemž mechanismus se podobá SN2 reakcím. Touto kvaternizací vznikne alkyltrifenylfosfoniová sůl, kterou lze izolovat nebo ihned nechat reagovat (v níže uvedeném případě s butyllithiem) za vzniku ylidu.
Protože má reakce SN2 mechanismus, tak stericky méně zatížené alkylhalogenidy přednostně reagují s trifenylfosfinem než se stericky výrazně zatíženějším alkylhalogenidem (jako je terc-butylbromid). Z tohoto důvodu obvykle jeden z možných syntetických postupů bývá pravděpodobnější než jiný.
Fosfoniumylidy jsou významnými reaktanty v organické chemii, obzvláště při syntézách přírodních látek s biologickými a léčivými účinky. Většina využití koordinace a-ketostabilizovaných fosfoniumylidů vyplývá z více možností koordinace v důsledku navázání různých funkčních skupin.
Nesymetrické fosforové ylidy
Alfa-ketostabilizované ylidy odvozené od bisfosfinů, jako jsou 1,2-bis(difenylfosfino)ethan (dppe), [Ph2PCH2PPh2]C(H)C(O)R, bis(difenylfosfino)methan (dppm), [Ph2PCH2CH2PPh2]C(H)C(O)R (R = Me, Ph nebo OMe) jsou významnou skupinou hybridních ligandů obsahujících fosfinové i ylidové funkční skupiny, mohou vytvářet ylidové a enolátové formy. Tyto ligandy se tak mohou zapojit do řady různých vazeb s ionty kovů, jako jsou palladium a platina.[3]
Ostatní druhy
Sirné ylidy
Dalšími běžnými skupinami jsou sulfoniumylidy a sulfoxoniumylidy, jako například Johnsonovo–Coreyovo–Čajkovského činidlo používané na přípravu epoxidů nebo ve Stevensově přesmyku.
Kyslíkaté
Karbonylylidy (RR'C=O+C−RR') lze získat otevíráním kruhu epoxidů nebo reakcemi karbonylových sloučenin s karbeny,[4] jež se většinou připravují z diazosloučenin. Oxoniumylidy (RR'-O+-C−R'R) vznikají reakcemi karbenů s ethery.
Dusíkaté
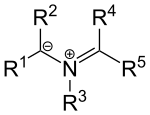
Existují také ylidy založené na dusíku, například azomethinylidy s obecným vzorcem:
Tyto sloučeniny lze považovat za spojení iminiových kationtů s karboanionty. Substituenty R1 a R2 jsou skupiny odtahující elektrony.
Tyto ylidy je možné připravit kondenzacemi α-aminokyselin s aldehydy nebo tepelným otevíráním kruhů některých N-substituovaných aziridinů.
Neobvyklou skupinou didusíkatých ylidů jsou izodiazeny: R1R2N+=N–. Rozkládají se za uvolnění dusíku (N2).
Stabilní karbeny také mají ylidové rezonanční struktury:
Ostatní
Haloniumylidy vznikají reakcemi allylhalogenidů a karbenoidů kovů. Po [2,3]-přesmyku se utváří homoallylhalogenid.
Aktivní forma Tebbeova činidla bývá často považována za ylid titanu. Podobně jako Wittigovo činidlo dokáže nahradit kyslíkové atomy karbonylových skupin methyleny. Ve srovnání s Wittigovým činidlem ho lze použít s větším rozmezím funkčních skupin.
Reakce
Významnou reakcí (fosforových) ylidů je například Wittigova reakce.
Dipolární cykloadice
Některé ylidy jsou 1,3-dipóly a vstupují do 1,3-dipolárních cykloadicí, například azomethinylid se účastní Pratových reakcí s fullereny.
Dehydropárování se silany
Za přítomnosti homoleptických katalyzátorů založených na prvcích 3. skupiny, Y[N(SiMe3)2]3, může trifenylfosfoniummethylid reagovat s fenylsilanem.[5]
Vzniklý ylid je stabilizován silylovou skupinou. Vedlejším produktem této reakce je plynný vodík.
Sigmatropní přesmyky
Mnoho ylidů může vstoupit do sigmatropních reakcí.[6]
Příkladem [2,3]-sigmatropní reakce je Sommeletův–Hauserův přesmyk. Stevensův přesmyk patří mezi [1,2]-přesmyky.
U některých fosfoniumylidů byly pozorovány [3,3]-sigmatropní reakce[7][8]
- (c) [[:en:User:|]] at the English Wikipedia, CC-BY-SA-3.0
Allylové přesmyky
Wittigova činidla reagují s nukleofily v SN2 allylových přesmycích:[9]
Po úvodní adici následuje eliminační reakce.
Odkazy
Související články
- 1,3-dipól
- Betain: neutrální molekula obsahující oniový kation a záporný náboj
- Zwitterion: neutrální molekula obsahujíécí jednu nebo více dvojic kladných a záporných nábojů
Externí odkazy
 Obrázky, zvuky či videa k tématu Ylidy na Wikimedia Commons
Obrázky, zvuky či videa k tématu Ylidy na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Ylide na anglické Wikipedii.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.y06728. (anglicky) DOI: 10.1351/goldbook.
- ↑ John McMurry. Organic Chemistry, 7th Ed.. [s.l.]: Thomson Brooks/Cole S. 720–722. (isbn = 978-0-495-11258-7)
- ↑ Seyyed Javad Sabouncheia, Mohsen Ahmadi. Zahra Nasri, Esmaeil Shams, Sadegh Salehzadeh, Yasin Gholiee, Roya Karamian, Mostafa Asadbegy, Sepideh Samiee. Synthesis, characterization, thermal, electrochemical, and DFT studies of mononuclear cyclopalladated complexes containing bidentate phosphine ligands and their biological evaluation as antioxidant and antibacterial agents. Comptes Rendus Chimie. 2013, s. 159–175. DOI 10.1016/j.crci.2012.10.006.
- ↑ Albert Padwa. Catalytic Decomposition of Diazo Compounds as a Method for Generating Carbonyl‐Ylide Dipoles. Helvetica Chimica Acta. 2005, s. 1357–1374. DOI 10.1002/hlca.200590109.
- ↑ Adi E. Nako; Andrew J. P. White; Mark R. Crimmin. A metal–amide dependent, catalytic C–H functionalisation of triphenylphosphonium methylide. Chemical Science. 2013, s. 691–695. Dostupné online. DOI 10.1039/C2SC21123H.
- ↑ J. B. Sweeney. Sigmatropic rearrangements of 'onium' ylides. Chemical Society Reviews. 2009, s. 1027–1038. DOI 10.1039/b604828p. PMID 19421580.
- ↑ Marcelle L. Ferguson; Todd D. Senecal; Todd M. Groendyke; Anna K. Mapp. [3,3]-Rearrangements of Phosphonium Ylides. Journal of the American Chemical Society. 2006, s. 4576–4577. DOI 10.1021/ja058746q. PMID 16594686.
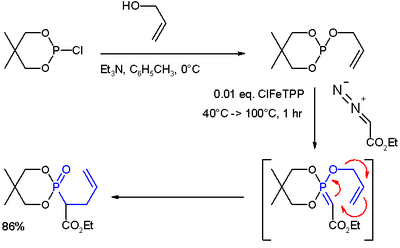
- ↑ (i) Reakcí allylalloholu s 2-chlor-5,5-dimethyl-1,3,2-dioxafosforinanem vzniká fosfit. (ii) Komplex karbenu a přechodného kovu (vytvořený reakcí ethyldiazoacetátu a ClFeTPP) se naváže na fosfit a vytvoří tak ylid. (iii) Přesmykem (modře) vznikne fosfonát.
- ↑ Ramesh M. Patel; Narshinha P. Argade. Facile SN2' Coupling Reactions of Wittig Reagents with Dimethyl Bromomethylfumarate: Synthesis of Enes, Dienes, and Related Natural Products. The Journal of Organic Chemistry. 2007, s. 4900–4904. DOI 10.1021/jo070728z. PMID 17539690.
Média použitá na této stránce
Autor: Hbf878, Licence: CC0
Chemical structure of azomethine ylides. Alternative charge symbols.
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC-BY-SA-3.0
Wittig Allylic rearrangement
Autor: Smokefoot, Licence: CC BY-SA 3.0
preparation of methylenetriphenylphosphorane
Autor: AdiNako, Licence: CC BY-SA 3.0
Yttrium catalysed dehydrocoupling of triphenylphosphonium methylide and phenylsilane.
Resonance structures of the methylenetriphenylphosphorane molecule, Ph3P=CH2.
Structure drawn in ChemDraw Ultra 11.0.Ball-and-stick model of the methylenetriphenylphosphorane molecule, Ph3P=CH2, as found in the crystal structure.
X-ray diffraction data from New J. Chem. (1989) 13, 341-352.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.(c) [[:en:User:|]] at the English Wikipedia, CC-BY-SA-3.0
Phosphonium ylide rearrangement