Plasmodium
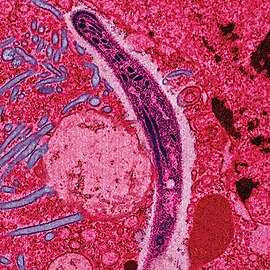 Sporozoit Plasmodium bergei v hostitelském druhu komára Anopheles stephensi | |
| Vědecká klasifikace | |
| Doména | Eukaryota |
| (nezařazeno) | SAR |
| (nezařazeno) | Alveolata |
| Kmen | výtrusovci (Apicomplexa) |
| Třída | krvinkovky (Haematozoea) |
| Řád | Haemosporida |
| Čeleď | Plasmodiidae |
| Rod | Plasmodium (zimnička) Marchiafava & Celli, 1885 |
| Některá data mohou pocházet z datové položky. | |
Plasmodium (česky někdy zimnička) je rod prvoků z kmene výtrusovci (Apicomplexa) a třídy krvinkovky (Haematozoea), jehož zástupci jsou známí jako původci malárie. Plasmodia představují prakticky celosvětově rozšířené parazity, přičemž jako jejich mezihostitelé vystupují výhradně plazi, ptáci a savci včetně člověka. Definitivními hostiteli a současně přenašeči jsou zejména komárovití (Culicidae), ačkoli některé druhy využívají i jiný bodavý dvoukřídlý hmyz, například flebotomy.
Během sání infikovaný komár do mezihostitele uvolňuje infekční stádia – sporozoity, kteří se následně v buňkách mezihostitele začnou nepohlavně množit. Tato tzv. merogonie probíhá v červených krvinkách, prvotně však v jiných buňkách, v případě všech lidských plasmodií v hepatocytech. Výslední merozoiti infikují další buňky mezihostitele. Do krvinek je vyjma merogonie situován též vznik nezralých sexuálních stádií, samčích a samičích gametocytů, čekajících na nasátí definitivním hostitelem. V jeho střevě následně dozrávají na gamety a dochází k pohlavnímu rozmnožování, jehož výsledkem je pohyblivý ookinet. Ookinet migruje střevní tkání, až se nakonec vyklene do dutiny hemocoelu v podobě tenkostěnné oocysty. Zde se vyvíjejí noví sporozoiti, již migrují do slinných žláz komára.
Tradiční rod Plasmodium zřejmě není monofyletický, ale odvozují se v rámci něj i další, často nepodobné rody malarických parazitů. Svůj původ má celý tento komplex pravděpodobně v ptácích. Plasmodia, u nichž neprobíhala dlouhodobá koevoluce s jejich hostiteli, mohou být obzvlášť virulentní. Tuto skutečnost demonstruje například drastický dopad ptačí malárie na havajské ptactvo, relativně nedávný „přeskok“ se předpokládá i u nejnebezpečnějšího lidského plasmodia, P. falciparum. V případě člověka platí, že malárie představuje nejsilnější známý selekční tlak na jeho genom.
Historie a taxonomie
Ačkoli malárie provází lidstvo již od prehistorických dob, jejího původce v krvi nakažených pacientů poprvé pozoroval teprve francouzský vojenský lékař Charles Louis Alphonse Laveran na konci 19. století. Pozorovaného malarického prvoka, konkrétně P. falciparum, pojmenoval Oscillaria malariae a své poznatky předložil Francouzské akademii lékařských věd v roce 1880. Navzdory prvotní skepsi se během několika let Laveranovy závěry dočkaly širokého uznání a za práci týkající se významu protozoí jako příčin nemocí byl Laveran roku 1907 oceněn Nobelovou cenou. Laveranův současník, ukrajinský vědec Vasilij Danilewskij, pozoroval krevní stádia plasmodií u ptáků okolo roku 1885. Zjištění, že vektorem plasmodií jsou komárovití, uskutečnil Ronald Ross v roce 1897. Přenos poprvé popsal na ptačích plasmodiích a i on za svůj přínos obdržel Nobelovu cenu (1902).[1]
Za popisnou autoritu rodového jména Plasmodium jsou pokládáni italští lékaři Ettore Marchiafava a Angelo Celli (1885).[2] Rod Plasmodium se řadí do řádu výtrusovců Haemosporida a v rámci něj do čeledi Plasmodiidae. Zástupci řádu Haemosporida se vyznačují přenosem na mezihostitele prostřednictvím vektoru z hmyzího řádu dvoukřídlých (Diptera) a mají pohyblivou zygotu, jež se transformuje v tenkostěnnou oocystu. Alespoň prekurzory pohlavních buněk, tzv. gametocyty, jsou svým vývojem vázány na krevní buňky mezihostitelského organismu.[3] Nutno dodat, že obecný termín „malarický parazit“ a jiné podobné nemusejí být ve zdrojích využívány striktně pro označení rodu Plasmodium, ale i jiných protist řádu Haemosporida.[4]
Vzhledem k tomu, že tradiční systematika řádu Haemosporida se zakládala na srovnání vzhledu krevních nátěrů, hostitelských druzích či geografické poloze, řád i jemu podřazené taxony prošly dosti košatou taxonomickou historií. Zřejmě i kvůli této skutečnosti byly nové nižší taxony popisovány častěji jako podrody v rámci již dobře definovaných rodů spíše než jako rody nové. V případě rodu Plasmodium první podrody vymezili Corradetti, Garnham & Laird (1963[5]), konkrétně pro ptačí plasmodia. Bray (1963[6]) popsal dva podrody plasmodií primátů zahrnující i lidské patogeny, konkrétně podrod Laverania pro P. falciparum a P. reichenowi a podrod Plasmodium pro ostatní druhy. Další podrody postupně následovaly.[7] Následující seznam podrodů včetně jejich mezihostitelů vychází ze seznamu publikovaného v práci Perkins (2014):

- Plasmodium Bray 1963 emend. Garnham, 1964 (primáti)
- Laverania Bray, 1963 (hominoidi)
- Vinckeia Garnham, 1964 (savci)
- Bennettinia Valkiūnas, 1997 (ptáci)
- Giovannolaia Corradetti et al., 1963 (ptáci)
- Haemamoeba Grassi & Feletti, 1890 (ptáci)
- Huffia Corradetti et al., 1963 (ptáci)
- Novyella Corradetti et al., 1963 (ptáci)
- Asiamoeba Telford, 1988 (ještěři)
- Carinamoeba Garnham, 1966 (ještěři)
- Lacertamoeba Telford, 1988 (ještěři)
- Ophidiella Garnham, 1966 (hadi)
- Paraplasmodium Telford, 1988 (ještěři)
- Sauramoeba Garnham, 1966 (ještěři)
Plasmodia od ostatních hemosporidií odlišuje nepohlavní rozmnožování (merogonie) v krvi mezihostitele, tvorba pigmentu hemozoinu a vývoj gametocytů v erytrocytech, resp. jejich prekurzorech – retikulocytech. Na základě molekulárně-fylogenetických studií nicméně tradičně definovaný rod Plasmodium zřejmě není monofyletický, nezahrnuje tedy společného předka a všechny jeho potomky (problematika evoluce rodu Plasmodium je rozebrána v kapitole Hostitelé a fylogeneze).[8][9] Tradiční definice rodu Plasmodium si však přesto zachovává výrazné praktické výhody i historické opodstatnění.[8]
Na základě dat uváděných CDC bylo k březnu 2024 známo více než 156 druhů plasmodií napadajích různé druhy obratlovců.[10] Ke studiu diverzity těchto protist se nicméně v současnosti často využívají i molekulární znaky, konkrétně úsek mitochondriálního genu pro cytochrom b. Podobný přístup prokázal historicky nerozpoznanou celosvětovou rozmanitost linií („druhů“) s odlišnými sekvencemi pro cytb, je však jen stěží použitelný pro klasickou taxonomii.[9] Linie však mohou pro praktické využití shrnovat specializované databáze, jako je MalAvi vytvořená pro malarické parazity ptáků.[11]
Popis

Plasmodia představují eukaryotní neboli jaderné organismy střídající ve svém životním cyklu různé vývojové formy žijící buďto v buňkách obratlovčích mezihostitelů (typicky v červených krvinkách neboli erytrocytech), anebo v těle definitivního hostitele, jímž bývají komáři. Nákazu obratlovčího hostitele způsobuje infekční, jednobuněčná vřetenovitě protáhlá forma označovaná jako sporozoit.[12]
Buňka plasmodia si vesměs zachovává typickou eukaryotní kompartmentalizaci, sporozoit tak zahrnuje jediné buněčné jádro, endoplazmatické retikulum, Golgiho aparát[12] a jednu mitochondrii, protaženou či rozvětvenou – nikoli hydrogenozom či mitozom, typický pro některé jiné známé parazitické prvoky.[13] Na mitochondrie eukaryot vázaný citrátový cyklus je nezbytný pro dokončení životního cyklu, nikoli však pro nepohlavní rozmnožování v mezihostiteli. Uhlíkové řetězce odbourávané v citrátovém cyklu poskytuje glukóza a zvláště glutamin.[14] Specifickou organelou, sdílenou i dalšími zástupci výtrusovců, je tzv. apikoplast, jenž má původ v sekundární endosymbióze, konkrétně vznikl pohlcením ruduchy. Apikoplast ztratil schopnost fotosyntézy, nicméně zprostředkovává různé nezbytné metabolické dráhy, včetně syntézy izoprenoidů, mastných kyselin, hemu a železo-sirných klastrů. Každá buňka obsahuje vždy jediný apikoplast ležící v blízkosti mitochondrie.[15]
Sdíleným znakem výtrusovců je pelikula tvořená vnější membránou a dvojicí dalších membrán, jež vytvářejí plochý měchýřek neboli alveolus. Ten podkládá plazmatickou membránu s výjimkou předního a zadního pólu buňky a tzv. mikropóru, jenž slouží jako buněčná ústa (cytostom) a v případě plasmodií je prostřednictvím nich transportován hemoglobin z infikovaných červených krvinek.[3] U forem pronikajících do hostitelských buněk se objevuje apikální komplex, další typický znak skupiny výstrusovců, jenž zprostředkovává invazi a modifikaci hostitelských buněk a v případě plasmodií je tvořen mikrotubulárním, tzv. polárním prstencem a specializovanými sekrečními „žlázkami“ (dvěma kyjovitými rhoptriemi a vláskovitými mikronémami). V apikálním komplexu chybí cytoskeletární válcovitý útvar zvaný konoid, jenž sice obecně schází u krvinkovek, ale je typický pro jiné zástupce výstrusovců. S částmi apikálního komplexu funkčně souvisí sekreční denzní granula, kulovité útvary rozptýlené v buňce.[12][3] Buněčnou membránu volných forem kryje povrchový proteinový plášť („coat“), který zprostředkovává počáteční kontakt s erytrocyty.[16]
S výjimkou krátké diploidní fáze spojené s pohlavním rozmnožováním v definitivním hostiteli představují plasmodia po většinu svého životního cyklu haploidní organismy. Jaderný genom zahrnuje 14 chromozomů, přičemž jeho velikost se pohybuje v rozmezí od zhruba 20 do 35 Mbp, s výrazně odlišným množstvím GC párů napříč jednotlivými druhy. Homologické geny se u jednotlivých druhů nacházejí v konzervovaných blocích, jež však mohou být rozptýleny v různém pořadí na různých chromozomech.[17] Velikost mitochondriální DNA činí pouhých 6 kbp. Plasmodia mají ve srovnání s ostatními jadernými organismy mitochondriální genom značně redukovan a postrádají mnoho genů typických pro jiná eukaryota. Mitochondriální genom kóduje pouze tři proteiny (cytochrom b a podjednotky I+III cytochrom c oxidasy) a chybí rovněž všechny geny pro tRNA.[13] Vlastní genetickou informaci nese apikoplast, jehož kódavací kapacita činí asi 35 kbp a kóduje asi 30 proteinů zapojených do výše zmíněných metabolických drah.[17]
Životní cyklus

Plasmodia cyklují mezi svými definitivními hostiteli – nejčastěji komáry – a obratlovčími mezihostiteli. Během sání infikovaného definitivního hostitele na mezihostiteli se do mezihostitele spolu se slinami dostává infekční dávka sporozoitů, kteří se následně v jeho buňkách začnou nepohlavně množit. Tento proces se označuje jako merogonie či schizogonie a případné patologické projevy s tím spojené pak jako malárie. Merogonie probíhá v červených krvinkách, ačkoli jí předchází tzv. exoerytrocytární merogonie v jiných buňkách, v případě všech lidských plasmodií v hepatocytech. Výsledek merogonie představují merozoiti, jejichž účelem je infikovat další buňky mezihostitele.[18]
Do erytrocytů je po několika dnech situován též vznik nezralých sexuálních stádií, samčích a samičích gametocytů, které zde čekají na nasátí definitivním hostitelem. V jeho střevě následně dozrávají na gamety a dochází k pohlavními rozmnožování, jehož výsledkem je pohyblivý ookinet. Ookinet migruje střevní tkání, až se nakonec vyklene do dutiny hemocoelu v podobě tenkostěnné oocysty. Zde se vyvíjejí noví sporozoiti, již po prasknutí oocysty migrují hemolymfou do slinných žláz definitivního hostitele.[18]
Vývoj v mezihostiteli

Během sání se do těla mezihostitele dostávají sporozoiti spolu se slinami přenašeče. V případě lidských plasmodií zůstávají na místě bodnutí asi 5–15 minut a následně pronikají do krevního oběhu, odkud mizí po asi 60 minutách.[12] Exoerytrocytární vývoj lidských (savčích) plasmodií následně probíhá v hepatocytech, přičemž povrchový circumsporozoitový protein (CSP) sporozoitů zajišťuje interakci s heparan-sulfátovými proteoglykany (HSPG) jaterních buněk. Jakmile se sporozoiti dostanou do oběhového systému, rychle pronikají do jaterních sinusoid a před samotnou infekcí hepatocytů zřejmě procházejí přes Kupfferovy buňky.[19][20] Než sporozoit napadne konkrétní hepatocyt, může zároveň procházet cytosolem dalších jaterních buněk, aniž by muselo dojít k jejich poškození.[21] V infikované mezihostitelské buňce si plasmodia kolem sebe vytvářejí uzavřenou růstovou komůrku, tzv. parazitoforní vakuolu, kterou tvoří vchlípená membrána napadené buňky modifikovaná proteiny z rhoptrií a denzních granul; tato strategie je typická i pro všechny ostatní vnitrobuněčné parazity ze skupiny výtrusovců. Ze sporozoita v parazitoforní vakuole se stává tzv. meront, mnohojaderná forma, která se pak prostřednictvím merogonie rozpadá na jednojaderné merozoity, označované v takovém případě termínem EE-merozoiti.[3]
Infikované hepatocyty se zvětšují, jejich jádro je zatlačeno ke straně.[12] Běžně se uvádí, že hepatocyty nakonec praskají, nicméně tento krok nikdy nebyl přímo pozorován. U P. berghei bylo popsáno pučení specializovaných váčků naplněných merozoity, což je pro parazita výhodné, neboť tyto tzv. merosomy se odvozují od hostitelské membrány a snáze unikají imunitní reakci hostitele. Souběžně bylo zjištěno, že ačkoli hepatocyt vykazuje apoptotické rysy, na svém povrchu nevystavuje fosfatidylserin, který signalizuje fagocytům, aby danou buňku pozřeli.[19][22] V případě lidských plasmodií jeden hepatocyt produkuje až 20 tisíc EE-merozoitů,[12] u některých plasmodií může být navíc exoerytrocytární vývoj opakován. Konečně, sporozoiti některých druhů plasmodií (P. vivax, P. ovale) mohou ustrnout v podobě klidových stádií, jednojaderných hypnozoitů dlouhodobě perzistujících v játrech a reaktivujících se i po několika měsících, resp. letech od infekce. Podobný relaps nelze zaměnit s tzv. rekrudescencí, návratu infekce z některých přežívajících krevních stádií.[3]

Ne všechna plasmodia však volí podobný exoerytrocytární vývoj. Sporozoiti ptačích plasmodií, konkrétně P. relictum, napadají retikulární buňky sleziny či kůže, kde se vyvíjejí v tzv. kryptozoity, odlišující se od EE-merozoitů savčích plasmodií tím, že nemohou napadat erytrocyty. Místo toho procházejí druhým exoerytrocytárním vývojem, kdy se jejich cílem stávají makrofágy v mnoha orgánech. Výslední tzv. metakryptozoiti mohou buďto konečně podstoupit merogonii v červených krvinkách (resp. zde vytvořit gametocyt), anebo vstoupit do cyklu reinfikujícího další makrofágy, anebo napadat endoteliální buňky v mnohých orgánech včetně mozku a jater. Endoteliální zoiti – fanerozoiti – mohou vytvářet klidové formy přetrvávající v těle napadeného ptáka teoreticky až do konce jeho života.[23]
Průnik merozoitů do erytrocytů probíhá dvoukrokově. Zatímco počáteční kontakt se uskutečňuje náhodně a je reverzibilní, jakmile se merozoit pohybovým manévrem orientuje apikálním pólem směrem k membráně erytrocytu, apikální spojení se stává ireverzibilní v důsledku interakcí parazitárních receptorů se specifickými ligandy v erytrocytární membráně (např. proteiny vázající retikulocyty RBP-1 a 2, merozoitový povrchový protein MSP-1 vázající zbytky kyseliny sialové aj.). Na zanoření membrány erytrocytu a tvorbě parazitoforní vakuoly se podílejí jak sekrece produktů apikálního komplexu, tak vlastní pohyb merozoitu.[12] Kolonizace erytrocytů je výhodná z toho pohledu, že na svém povrchu postrádají molekuly hlavního histokompatibilní komplexu rozpoznávaného cytotoxickými T-lymfocyty.[24] Protilátkové odpovědi se plasmodia brání změnou antigenů, které vystavují na povrchu červených krvinek. Erytrocytární membránový protein P. falciparum (Pf) navíc brání degradaci červených krvinek ve slezině tím, že je adheruje k endotelu cév (s čímž se však pojí těžké patologie).[24]

Během časné fáze infekce tvoří plasmodium tzv. stádium „prstýnku“, pojmenované na základě podobnosti s tímto šperkem. Pomyslnou obroučku představuje cytoplazma s ribozomy, pomyslný kámen buněčné jádro (diskovité nebo protáhlé) a dutinu prstýnku méně denzní cytoplazma s centrální vakuolou. Prstýnek postupně získává nepravidelný amébovitý tvar (trofozoit), v centrálních vakuolách se ukládá žlutohnědý pigment hemozoin, produkt trávení hemoglobinu, jenž parazit pohlcuje pomocí cytostomů. Vnitrobuněčná forma parazita, která následně prochází opakovaným jaderným dělením, se označuje jako schizont, výsledný útvar pak jako rozeta či segmenter.[12][3] Navazující cytokineze musí být spojena nejen se správnou segregací jader, ale i dalších buněčných komponent. Apikoplast i mitochondrie se během jaderného dělení stávají vysoce rozvětvenými a následně se rozdělí na mnohačetné organely, společně přesně segregující do dceřiných merozoitů.[13][15]
Asexuální rozmnožování v erytrocytech nakonec dává vzniknout nové generaci merozoitů (E-merozoiti), jejichž počet závisí na druhu, v případě lidských plasmodií činí 8 až 64 na krvinku.[25] Merozoiti opouštějí erytrocyt typicky jeho rupturou, během níž se uvolní i tzv. reziduální tělísko s krystaly malarického pigmentu. Merozoiti následně pronikají do dalších erytrocytů, nikoli však do hepatocytů (v případě savčích plasmodií). Ruptura jednotlivých erytrocytů v organismu je vzájemně synchronizována, nastává vždy po několika dnech.[12] Někteří merozoiti se po průniku do erytrocytů přemění do odlišného vývojového stadia zvaného gametocyt, které nedorůstá ve schizonta, zaokrouhluje se a chybí mu centrální vakuola.[12] Jde o prekurzor samčích, respektive samičích gamet, v obou těchto případech jsou si gametocyty vzhledově podobné. Čas, kdy dochází k tvorbě gametocytů, je mezi jednotlivými plasmodii proměnlivý. Zatímco některá produkují gametocyty už během prvních cyklů nepohlavního rozmnožování v erytrocytech, u jiných se gametocyty objevují až po větším množství erytrocytárních generací.[25]
Vývoj v definitivním hostiteli
Erytrocyty se zralými gametocyty kolují v periferní krvi mezihostitele. Gametocyty zde v G1 fázi buněčného cyklu čekají na nasátí definitivním hostitelem, v opačném případě po několika dnech degenerují. V lumen středního střeva definitivního hostitele se gametocyty z červených krvinek uvolňují a pouze jejich zralé formy pokračují v dalším vývoji za vzniku samčích mikrogamet a samičích makrogamet. Samčí mikrogamety jsou bičíkaté, přičemž vznikají z gametocytu, jenž prochází trojí replikací DNA (jeden samčí gametocyt tak produkuje 8 mikrogamet).[12]
Mikrogameta je pohyblivá a jejím splynutím s makrogametou vzniká zygota, jediné diploidní stádium v životním cyklu plasmodia. Nezbytná mitochondrie a apikoplast se dědí ze strany samičích makrogamet. Zygota brzy podstupuje meiózu a stává se z ní pohyblivý červovitý ookinet se čtyřmi haploidními genomy v buněčném jádru, jenž následně proniká stěnou střeva a usazuje se na jeho vnějším povrchu.[25] Tento krok však prvně vyžaduje překročení nebuněčné chitinózní peritrofické membrány, která u hmyzu obaluje přijímanou potravu a slouží jako fyzická bariéra před patogeny či jako ochrana proti mechanickému poškození trávicí trubice od přijímané potravy. Plasmodia peritrofickou membránu umí rozrušit díky produkovaným chitinázám, respektive aspartyl-proteázám.[26] V případě P. gallinaceum představuje produkovaná chitináza proenzym aktivovaný teprve proteázami ve střevě komára.[27]
Ookinet následně invaduje střevní epitel, první kontakt zprostředkovávají lektiny vázající glykoproteiny na epiteliálních buňkách. Doba průniku epitelem je v tomto případě časově omezená – napadené epiteliální buňky totiž spouštějí dráhy programované buněčné smrti. Úspěšný ookinet se následně usazuje na vnější straně epitelu pod bazální laminou, jejíž složky (kolagen, laminin) zřejmě spouštějí jeho vývoj do oocysty. V oocystě, jež je navíc kryta ochranným pouzdrem, prostřednictvím nepohlavního rozmnožování (sporogonie) vzniká velké množství nových sporozoitů, přičemž zralá oocysta zaujímá přibližně 1000násobek svého původního objemu. Zralé oocysty se rozpadají, možná aktivitou specifických proteáz, a sporozoiti se uvolňují do hemolymfy, kterou migrují až ke slinným žlázám definitivního hostitele. Průnik specificky probíhá v zadních bočních a středních lalocích slinné žlázy, během invaze slinné žlázy sporozoiti vytvářejí pouze dočasné parazitiforní vakuoly. Zajímavostí je, že sporozoiti neproniknuvší do slinných žláz jsou pro obratlovčího hostitele prakticky neinfekční, neboť teprve tento krok u nich spouští rozsáhlé změny v genové expresi.[27] U plasmodií způsobujících lidskou malárii může druhá část životního cyklu od gametocytů po nové sporozoity trvat 10–18 dnů.[25]
Populace plasmodií v definitivním hostiteli prochází dvěma koly výrazné redukce. Ačkoli definitivní hostitel může nasát tisíce červených krvinek s gametocyty, vzniká z nich pouhých 50–100 ookinet, přičemž zdaleka ne všechny se úspěšně usadí na vnější stěně střeva. Při předpokladu maximálně 5 úspěšně vytvořených oocyst, které nepohlavním rozmnožováním dají vzniknout 50 000 sporozoitů, se při sání dostává do nového mezihostitele pouze 15–80 sporozoitů.[28]
Hostitelé a fylogeneze

Plasmodia v klasickém pojetí (tedy v souladu s kapitolou Historie a taxonomie) představují prakticky celosvětově rozšířené parazity, přičemž jejich mezihostitele představují výhradně suchozemští obratlovci etablovaní z plazů, ptáků a savců.[3] Savčí a plazí plasmodia bývají více hostitelsky specifická než plasmodia ptačí.[29]
Plazí plasmodia většinou infikují různé druhy ještěrů, pouze jediný uznávaný podrod, Ophidiella, infikuje hady.[7] U krokodýlů nebyla přítomnost plasmodií prokázána.[30] Ptačí plasmodia napadají extrémně široké množství různých ptačích linií, s největší diverzitou v případě hrabavých, měkkozobých a pěvců (naproti tomu chybí záznamy např. u pštrosů, myšáků a trogonů). Prakticky celosvětově rozšířený a ekologicky významný druh představuje P. relictum, napadající více než 400 různých druhů ptáků ze 70 různých čeledí a jeden z hlavních agens ptačí malárie.[31] Významným zástupcem je i P. gallinaceum napadající drůbež.[32] Značné množství různých linií ptačích plasmodií (resp. malarických parazitů v širším smyslu) shrnuje databáze MalAvi.[11]

Klasické podrody Laverania a Plasmodium napadají primáty, podrod Vinckeia i další řády savců,[9] včetně hlodavců, letounů či sudokopytníků.[33][34] Plasmodia izolovaná z afrických lesních hlodavců slouží jako experimentální modely přenosné na laboratorní zvířata, etablují se mezi nimi druhy jako P. berghei, P. chabaudi či P. yoelli.[3] Nejvýznamnějšími primátími plasmodii jsou zástupci infikující člověka, tj. P. falciparum, P. vivax, P. malariae, P. ovale. P. falciparum se řadí v rámci podrodu Laverania, zbylé v rámci podrodu Plasmodium a zatímco nejhojnější druh představuje P. vivax, infekce P. falciparum doprovází nejvyšší míra smrtnosti. K této kanonické čtveřici se může přiřazovat i původně opičí P. knowlesi, jež CDC považuje stále za zoonotické; mezi další zoonotická plasmodia patří např. P. cynomolgi, P. simium a P. brasilianum. Malárie představuje již od prehistorických dob snad nejvýznamnější infekční onemocnění člověka a ještě k roku 2019 přibylo více než 229 milionů nových klinických případů, z toho 368 000 úmrtí. Malárie se omezuje na tropické a subtropické oblasti, v minulosti byla rozšířena i v Severní Americe, Evropě, dokonce i v částech severní Asie.[10][35]
Definitivního hostitele a vektora plasmodií představuje dvoukřídlý hmyz. Drtivá většina známých plasmodií využívá jako přenašeče komárovité (Culicidae), navzdory této široce rozšířené informaci však nikoli všechna. Plazí rod Paraplasmodium se přenáší prostřednictvím flebotomů, drobnějšího dvoukřídlého hmyzu z čeledi koutulovitých (Psychodidae), známějšího především v úloze vektora parazitických protist rodu Leishmania. Přenos ostatních plazích plasmodií zůstává navíc jen špatně probádán. V případě ptačích plasmodií vystupují jakožto přenašeči komáři z podčeledi Culicinae, jako jsou rody Culex, Aedes a Culiseta. Komáři z podčeledi Anophelinae, včetně slavného rodu Anopheles, infikují primárně savce,[9] přičemž vektory lidské malárie představuje asi čtyřicet různých druhů, respektive druhových komplexů anofelů a další desítky sporadických přenašečů.[12] V experimentálních podmínkách mohou v anofelech dokončit vývoj i ptačí plasmodia.[31]
Hypotéza fylogeneze na základě Galen & kol., 2018 (klíčové však je, že rod Plasmodium nepředstavuje monofylum)[8]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Předpokládaná fylogeneze řádu Haemosporida je dlouhodobě nestabilní, přičemž situaci komplikuje jak nedostatečné taxonomické pokrytí, tak nedostatečné množství znaků pro robustní fylogenetické hypotézy. Pravděpodobnější je zřejmě původ v ptácích,[8] některé studie však podporovaly hluboký rozkol mezi klady infikujícími savce a sauropsidy.[36] Významné rody řádu Haemosporida se mohly diverzifikovat současně s radiací jejich hostitelských obratlovčích řádů po začátku terciéru před asi 66 miliony lety. Klad zahrnující pro člověka nejnebezpečnější P. falciparum se zřejmě odchýlil od kladu zahrnujícího zbylé druhy plasmodií infikující člověka, resp. zejména úzkonosé opice, a to možná v době divergence podčeledi Homininae.[9] Nález infikovaného komára konzervovaného v jantaru potvrzuje, že plasmodia existovala a komáry ke svému přenosu využívala již v polovině terciéru.[37]
Tradičně chápaný rod Plasmodium podle molekulární fylogenetiky není monofyletický a je zřejmě součástí širšího kladu s rody Hepatocystis, Nycteria a Polychromophilus (napadajícími letouny i jiné savce). Postavení výše zmíněných rodů nicméně zůstává sporné. Pozice rodu Hepatocystis se může různit v souvislosti se zahrnutím diverzifikovaného kladu lemuřích plasmodií, sdílejících společného předka s jinými plasmodii afrických primátů; rod Polychromophilus může sdílet společného předka s malarickými parazity nalezenými u kopytníků; rod Nycteria může vystupovat v kladu se savčími plasmodii plus rodem Hepatocystis, nebo jako sesterská skupina k plazím plasmodiím.[9] Studie z roku 2018 spekuluje, že komplex zahrnující Polychromophilus, Nycteria, Hepatocystis a Plasmodium se odvozuje z předka infikujícího sauropsidy, který přeskočil na savčí hostitele a z nich zpětně na sauropsidní linie (šupinatí, ptáci), významnou roli v diverzifikaci malarických parazitů přičemž mohli hrát letouni. Pozoruhodné je, že výše zmíněné rody postrádají charakteristické znaky tradičních plasmodií; například rod Hepatocystis nepodstupuje erytrocytární merogonii a coby jeho vektor vystupují spíše pakomárcovití z rodu Culicoides.[8]
Virulence a ekologicko-evoluční souvislosti

Infekcí krevních buněk představují plasmodia zajímavý paradox: příbuzné rody Haemoproteus, Leucocytozoon či savčí Hepatocystis (jenž se však v rámci tradičních plasmodií odvozuje) využívají krevní buňky pouze k šíření pohlavních stádií, nikoli k nepohlavnímu rozmnožování. Cyklické malarické záchvaty představují přímý důsledek synchronizovaného rozpadu červených krvinek, jenž vyvolává silnou reakci imunitního systému, navíc pouze malá část klonů se přemění na gametocyty, takže z tohoto pohledu vypadá strategie plasmodií jako nevýhodná. Hypotéz vysvětlující tento paradox existuje vícero. Podle klasického výkladu mohou asexuální stádia svým množstvím „odvádět pozornost“ imunitního systému od gametocytů, jiné hypotézy operují s potlačením imunitní odpovědi, například proti exoerytrocytárním formám s možným usnadněním reinfekcí prostřednictvím hypnozoitů.[29] Klinické projevy zároveň mohou usnadnit samotné šíření parazita z toho pohledu, že hostitel může být pro komáry atraktivnější – minimálně se hůře brání jejich útokům. Manipulační aktivity parazita prostřednictvím podobných nespecifických patologických projevů však bývají jen těžko prokazatelné.[38]
Úroveň virulence se zároveň u jednotlivých druhů plasmodií liší. V případě lidských plasmodií představuje relativně mírného zástupce P. vivax – napadá výhradně retikulocyty (prekurzory zralých erytrocytů), normálně tvořící jen asi 2 % krevního obrazu. P. malariae napadá erytrocyty na konci jejich životnosti, spolu s nízkou parazitémií (0,2 %) ji to rovněž předurčuje k relativně benigním infekcím. Kvůli schopnosti adherovat krvinky ke stěnám cév a napadat erytrocyty různého stáří je naopak nejnebezpečnější P. falciparum.[3] P. falciparum se kvůli své vysoké virulenci uplatňuje zejména v tropech, kde jsou jeho přenašeči aktivní v průběhu celého roku, zatímco v subtropech či mírných oblastech s periodičtější aktivitou komárů výhodu získávají spíše plasmodia schopná tvořit hypnozoity či ta s dlouhou inkubační dobou.[38]
Fylogeneze parazitů často zrcadlí fylogenezi jejich hostitelských druhů (Fahrenholzovo pravidlo). V případě plasmodií případ podobných speciačních událostí dokumentovala například studie zkoumající plasmodia madagaskarských lemurů.[39] Zvlášť vysokou virulenci mohou mít plasmodia, s nimiž hostitel neměl možnost v průběhu historie interagovat. Například ptačí plasmodia jsou obzvláště nebezpečná pro tučňáky chované v zajetí, kteří se v přirozených podmínkách s těmito jinak prakticky celosvětově rozšířenými patogeny nesetkali. Drastický dopad měla ptačí malárie na ptactvo Havajských ostrovů, kde představuje hlavní příčinu vyhynutí širokého spektra původních druhů, jako jsou šatovníci. Populace přežívajících druhů byly zároveň vytlačeny z nížin do vyšších nadmořských výšek, kde schází vektor P. relictum, zavlečený komár Culex quinquefasciatus.[31] Srovnávací studie z roku 1995 zjistila, že zatímco jediné bodnutí infikovaným komárem stačilo na zabití 9 z 10 studovaných šatovníků šarlatových (Drepanis coccinea), u nepůvodní panenky muškátové (Lonchura punctulata) nepropuklo onemocnění ani v jednom případě.[40] V případě zmíněného P. falciparum se očekává, že jeho původního hostitele představovaly gorily a k přenosu na člověka došlo teprve před několika tisíci lety (historicky byl zvažován i přeskok z ptačích hostitelů[41]). U goril přičemž infekce opět nepůsobí významné patologie.[42]
Jednou z klíčových adaptací, která plasmodiím umožňuje obcházet imunitní systém, je přítomnost variabilních multigenových rodin kódujících širokou paletu povrchových antigenů vystavovaných na povrchu červených krvinek. Hnací sílu pro generování nových genových variant představují zřejmě specifické metody opravy DNA (dvouřetězcové zlomy DNA jsou například opravovány výhradně podle podobné „předlohy“ na jiných chromozomech, tj. homologní rekombinací).[43] Jiný typ evolučních závodů ve zbrojení demonstruje P. vivax, jež na erytrocytech typicky vyžaduje přítomnost specifického antigenu Duffy, některé kmeny se ale adaptovaly i na Duffy-negativní jedince.[44] Komplikaci při vývoji léčiv představuje zase selektování rezistentních linií, a některé starší medikamenty (chlorochin) jsou proto k léčbě malárie již neúčinné.[3]
Hostitel může být nakažen více různými klony či druhy plasmodií, s relativně různorodým výsledkem vzájemných interakcí: někdy ústí ve vzájemnou konkurenci, jindy je však alespoň pro jednu stranu taková situace výhodná. Infekce P. agamae například vede ke zvýšení počtu retikulocytů, jež může ve svém životním cyklu využít P. giganteum. Naproti tomu P. falciparum brání tvorbě retikulocytů a potlačuje tak možnost společné infekce s P. vivax. V některých případech přináší výhody, když je hostitelský imunitní systém vystaven většímu množství různých klonů jednoho plasmodia – takové klony se pak mohou přenášet společně. Nákaza větším počtem různých klonů stejného druhu zároveň může vychylovat poměr samčích a samičích gametocytů; oproti infekci klonem jediným se totiž vyplatí produkovat větší množství samčích gametocytů, které mohou hypoteticky oplodnit všechny budoucí samičí gamety.[29] Konečně, na hostitele může mít dopad nejen infekce plasmodii, ale i jejich interakce s jinými symbionty. V případě havajských ptáků bývají, možná v důsledku společného přenosu, malarické infekce doprovázeny ptačími neštovicemi, jejichž původce představuje DNA virus rodu Avipoxvirus. Souvislosti mezi ptačí malárií a ptačími neštovicemi však zůstávají jen špatně probádány.[23] Nákazu P. falciparum doprovází zvýšená náchylnost vůči střevním bakteriálním infekcím (netyfoidní salmonelly),[45] v kombinaci s EB virem tato zimnička také platí za hlavní rizikový faktor pro endemický Burkittův lymfom.[46] Naproti tomu aktivita střevní mikroflóry snižuje úroveň infekce plasmodii u komárů (zjištěno u Anopheles gambiae).[47]
V rámci komárů se plasmodiální infekce obecně neprojevuje příliš vysokou virulencí, neboť samotný vývoj v komárovi běžně trvá 1 až 2 týdny a zkrácení doby jeho života by mohlo být pro přenos parazita fatální.[29] Infekce plasmodii obecně snižuje biologickou zdatnost komárů, nicméně aktivace imunitních reakcí může mít na jejich biologickou zdatnost týž efekt, takže je možné, že se prostřednictvím vzájemné koevoluce jako stabilní ukázala být strategie, kdy komáři přenášejí relativně nízký počet potomstva plasmodií.[27] Infekce plasmodii může dokonce zvyšovat délku života definitivního hostitele (což je pro parazita výhodné), ale současně se snižuje plodnost.[29] Komáři jsou svými parazity zároveň cíleně manipulováni, aby maximalizovali jejich přenos a jsou i častěji přitahováni na infikované hostitele. Konkrétně studie z roku 2017 popsala, že jeden z metabolitů P. falciparum, (E)-4-hydroxy-3-methyl-but-2-enylpyrofosfát, způsobuje zvýšené uvolňování CO2, aldehydů a monoterpenů z lidských erytrocytů, čímž činí takového mezihostitele atraktivnějšího pro komáry.[48][49] Komáři s přítomností sporozoitů ve slinných žlázách se zároveň stávají útočnějšími a pokoušejí se přijímat větší množství krve ve srovnání se svými neinfikovanými protějšky. Tato skutečnost může vysvětlovat, proč se do hostitele dostane jen zlomek sporozoitů ze slinných žláz, protože ti snad plní i manipulační roli. Během samotného vývoje oocyst se naopak komáři stávají méně útočnými.[29][49] V případě plazího P. mexicanum bylo zjištěno, že manipuluje s chováním svého vektora, flebotoma Lutzomyia vexator, tím způsobem, aby preferoval teplotu výhodnou pro rychlejší vývoj parazita. Rychlý vývoj je nutný, neboť samice Lutzomyia vexator jsou relativně krátkověké a na hostitelích sají maximálně třikrát za život.[50]

Malárie představuje nejsilnější známý nedávný selekční tlak na lidský genom (P. falciparum se rozšířilo teprve v souvislosti s neolitickou revolucí). U lidských populací se vyvinuly nezávisle na sobě různé alely udělující svým nositelům různou míru rezistence vůči infekci plasmodii, přičemž prostřednictvím selekce ve prospěch heterozygotů se mohou rozšiřovat dokonce i alely, jejichž vliv je pro homozygoty fatální.[51] Učebnicový příklad představuje problematika srpkovité anémie, jejímž původcem je mutace genu pro hemoglobin, v homozygotním genotypu vedoucí ke smrti (kombinace SS), ale v populaci přesto udržována na vyšších hodnotách v důsledku skutečnosti, že heterozygoti s jednou alelou normální a jednou mutovanou (AS) jsou rezistentní vůči málarii ve srovnání s homozygoty se dvěma normálními alelami (AA).[52] Zajímavý příklad výsledku selekčního tlaku ze strany plasmodií může představovat i rudá hlava jihoamerické opice uakariho šarlatolícího (Cacajao calvus), podle některých hypotéz právě indikátor dobrého zdravotního stavu, ačkoli podobné intepretace zůstávají předmětem vědeckých debat.[53] Populace určitých druhů však mohou z přítomnosti plasmodií naopak těžit, pokud tito parazité zasahují do kompetičních vztahů s jejich konkurenty. Plasmodium azurophilum například umožňuje koexistenci dvou druhů leguánovitých ještěrů na ostrově Svatý Martin: Anolis gingivinus představuje lepšího kompetitora než příbuzný A. wattsi, nicméně jen v oblastech bez P. azurophilum (jež zároveň jen zřídka napadá A. wattsi).[54]
Odkazy
Reference
- ↑ COX, Francis EG. History of the discovery of the malaria parasites and their vectors. Parasites & Vectors. 2010-02-01, roč. 3, čís. 1, s. 5. Dostupné online [cit. 2024-04-07]. ISSN 1756-3305. doi:10.1186/1756-3305-3-5. PMID 20205846.
- ↑ IRMNG - Plasmodium Marchiafava & Celli, 1885. www.irmng.org [online]. [cit. 2024-04-07]. Dostupné online.
- ↑ a b c d e f g h i j VOLF, Petr; HORÁK, Petr. Paraziti a jejich biologie. Praha: Triton, 2007. ISBN 9788073870089, ISBN 8073870088. S. 90–93, 106–112.
- ↑ VOTÝPKA, Jan. Haemospororida Danielewski 1885. tolweb.org [online]. 2011 [cit. 2024-04-08]. Dostupné online.
- ↑ CORRADETTI, A.; GARNHAM, P.; LAIRD, M. New classification of the avian malaria parasites. Parassitologia. 1963.
- ↑ BRAY, R. S. The Malaria Parasites of Anthropoid Apes. The Journal of Parasitology. 1963, roč. 49, čís. 6, s. 888–891. Dostupné online [cit. 2024-04-07]. ISSN 0022-3395. doi:10.2307/3275713.
- ↑ a b PERKINS, Susan L. Malaria's Many Mates: Past, Present, and Future of the Systematics of the Order Haemosporida. Journal of Parasitology. 2014-02, roč. 100, čís. 1, s. 11–25. Dostupné online [cit. 2024-04-07]. ISSN 0022-3395. doi:10.1645/13-362.1. (anglicky)
- ↑ a b c d e GALEN, Spencer C.; BORNER, Janus; MARTINSEN, Ellen S. The polyphyly of Plasmodium : comprehensive phylogenetic analyses of the malaria parasites (order Haemosporida) reveal widespread taxonomic conflict. Royal Society Open Science. 2018-05, roč. 5, čís. 5, s. 171780. Dostupné online [cit. 2024-04-07]. ISSN 2054-5703. doi:10.1098/rsos.171780. PMID 29892372. (anglicky)
- ↑ a b c d e f PACHECO, M. Andreína; ESCALANTE, Ananias A. Origin and diversity of malaria parasites and other Haemosporida. Trends in Parasitology. 2023-07, roč. 39, čís. 7, s. 501–516. Dostupné online [cit. 2024-04-07]. ISSN 1471-4922. doi:10.1016/j.pt.2023.04.004.
- ↑ a b CDC - DPDx - Malaria. www.cdc.gov [online]. 2024-03-19 [cit. 2024-04-08]. Dostupné online. (anglicky)
- ↑ a b BENSCH, Staffan; HELLGREN, Olof; PÉREZ-TRIS, Javier. MalAvi: a public database of malaria parasites and related haemosporidians in avian hosts based on mitochondrial cytochrome b lineages. Molecular Ecology Resources. 2009-09, roč. 9, čís. 5, s. 1353–1358. Dostupné online [cit. 2024-04-08]. ISSN 1755-0998. doi:10.1111/j.1755-0998.2009.02692.x. PMID 21564906.
- ↑ a b c d e f g h i j k l JÍRA, Jindřich. Lékařská protozoologie : protozoální nemoci. Praha: Galén, 2009. Kapitola Malarická plazmodia a malárie.
- ↑ a b c VAN DOOREN, Giel G.; STIMMLER, Luciana M.; MCFADDEN, Geoffrey I. Metabolic maps and functions of the Plasmodium mitochondrion. FEMS Microbiology Reviews. 2006-07, roč. 30, čís. 4, s. 596–630. Dostupné online [cit. 2024-04-03]. ISSN 1574-6976. doi:10.1111/j.1574-6976.2006.00027.x. (anglicky)
- ↑ MACRAE, James I.; DIXON, Matthew WA; DEARNLEY, Megan K. Mitochondrial metabolism of sexual and asexual blood stages of the malaria parasite Plasmodium falciparum. BMC Biology. 2013-06-13, roč. 11, čís. 1, s. 67. Dostupné online [cit. 2024-04-03]. ISSN 1741-7007. doi:10.1186/1741-7007-11-67. PMID 23763941.
- ↑ a b ELAAGIP, Arwa; ABSALON, Sabrina; FLORENTIN, Anat. Apicoplast Dynamics During Plasmodium Cell Cycle. Frontiers in Cellular and Infection Microbiology. 2022-04-29, roč. 12. Dostupné online [cit. 2024-04-03]. ISSN 2235-2988. doi:10.3389/fcimb.2022.864819. PMID 35573785.
- ↑ BANNISTER, L. H.; MITCHELL, G. H.; BUTCHER, G. A. Structure and development of the surface coat of erythrocytic merozoites of Plasmodium knowlesi. Cell and Tissue Research. 1986, roč. 245, čís. 2, s. 281–290. Dostupné online [cit. 2024-04-04]. ISSN 0302-766X. doi:10.1007/BF00213933. PMID 3742563.
- ↑ a b GARDNER, Malcolm J.; HALL, Neil; FUNG, Eula. Genome sequence of the human malaria parasite Plasmodium falciparum. Nature. 2002-10, roč. 419, čís. 6906, s. 498–511. Dostupné online [cit. 2024-04-03]. ISSN 1476-4687. doi:10.1038/nature01097. (anglicky)
- ↑ a b HAUSMANN, K.; HÜLSMANN, N. Protozoologie. Praha: Academia, 2003. S. 100–110.
- ↑ a b PRUDÊNCIO, Miguel; RODRIGUEZ, Ana; MOTA, Maria M. The silent path to thousands of merozoites: the Plasmodium liver stage. Nature Reviews Microbiology. 2006-11, roč. 4, čís. 11, s. 849–856. Dostupné online [cit. 2024-04-06]. ISSN 1740-1534. doi:10.1038/nrmicro1529. (anglicky)
- ↑ BAER, Kerstin; ROOSEVELT, Michael; CLARKSON, Allen B. Kupffer cells are obligatory for Plasmodium yoelii sporozoite infection of the liver. Cellular Microbiology. 2007-02, roč. 9, čís. 2, s. 397–412. Dostupné online [cit. 2024-04-06]. ISSN 1462-5814. doi:10.1111/j.1462-5822.2006.00798.x. (anglicky)
- ↑ MOTA, M. M.; PRADEL, G.; VANDERBERG, J. P. Migration of Plasmodium sporozoites through cells before infection. Science (New York, N.Y.). 2001-01-05, roč. 291, čís. 5501, s. 141–144. Dostupné online [cit. 2024-04-06]. ISSN 0036-8075. doi:10.1126/science.291.5501.141. PMID 11141568.
- ↑ STURM, Angelika; AMINO, Rogerio; VAN DE SAND, Claudia. Manipulation of host hepatocytes by the malaria parasite for delivery into liver sinusoids. Science (New York, N.Y.). 2006-09-01, roč. 313, čís. 5791, s. 1287–1290. Dostupné online [cit. 2024-04-06]. ISSN 1095-9203. doi:10.1126/science.1129720. PMID 16888102.
- ↑ a b Huijben, S.; Schaftenaar, W.; Wijsman, A.; Paaijmans, K. P.; Takken, W. Avian malaria in Europe: An emerging infectious disease?. In: TAKKEN, W.; KNOLS, B. G. J. Emerging Pests and Vector-borne Diseases in Europe. Wageningen: Wageningen Academic Publishers, 2007. Dostupné online. ISBN 9789086860531. S. 59–74. (anglicky)
- ↑ a b CHANDLEY, Pankaj; RANJAN, Ravikant; KUMAR, Sudhir. Host-parasite interactions during Plasmodium infection: Implications for immunotherapies. Frontiers in Immunology. 2023, roč. 13. Dostupné online [cit. 2024-04-07]. ISSN 1664-3224. doi:10.3389/fimmu.2022.1091961. PMID 36685595.
- ↑ a b c d SATO, Shigeharu. Plasmodium—a brief introduction to the parasites causing human malaria and their basic biology. Journal of Physiological Anthropology. 2021-01-07, roč. 40, čís. 1, s. 1. Dostupné online [cit. 2024-04-07]. ISSN 1880-6805. doi:10.1186/s40101-020-00251-9. PMID 33413683.
- ↑ KAUR, Hargobinder; PACHECO, M. Andreina; GARBER, Laine. Evolutionary Insights into the Microneme-Secreted, Chitinase-Containing High-Molecular-Weight Protein Complexes Involved in Plasmodium Invasion of the Mosquito Midgut. Infection and Immunity. 2022-01-25, roč. 90, čís. 1. Dostupné online [cit. 2024-04-07]. ISSN 0019-9567. doi:10.1128/IAI.00314-21. PMID 34606368. (anglicky)
- ↑ a b c SMITH, R. C.; JACOBS-LORENA, M. Plasmodium–Mosquito Interactions: A Tale of Roadblocks and Detours. Advances in Insect Physiology. 2010. doi:10.1016/B978-0-12-381387-9.00004-X.
- ↑ SINDEN, R. Plasmodium invasion of mosquito cells: hawk or dove?. Trends in Parasitology. 2001-05-01, roč. 17, čís. 5, s. 209–211. Dostupné online [cit. 2024-04-07]. doi:10.1016/S1471-4922(01)01928-6.
- ↑ a b c d e f PAUL, R. E. L.; ARIEY, F.; ROBERT, V. The evolutionary ecology of Plasmodium. Ecology Letters. 2003-09, roč. 6, čís. 9, s. 866–880. Dostupné online [cit. 2024-04-09]. ISSN 1461-023X. doi:10.1046/j.1461-0248.2003.00509.x. (anglicky)
- ↑ HUCHZERMEYER, Fritz W. Crocodiles: biology, husbandry and diseases. Wallingford: CABI-Publ, 2003. 337 s. Dostupné online. ISBN 978-0-85199-656-1. S. 188.
- ↑ a b c LAPOINTE, Dennis A.; ATKINSON, Carter T.; SAMUEL, Michael D. Ecology and conservation biology of avian malaria. Annals of the New York Academy of Sciences. 2012-02, roč. 1249, čís. 1, s. 211–226. Dostupné online [cit. 2024-04-08]. ISSN 0077-8923. doi:10.1111/j.1749-6632.2011.06431.x. (anglicky)
- ↑ KITTICHAI, Veerayuth; KAEWTHAMASORN, Morakot; THANEE, Suchansa. Classification for avian malaria parasite Plasmodium gallinaceum blood stages by using deep convolutional neural networks. Scientific Reports. 2021-08-19, roč. 11, čís. 1, s. 16919. Dostupné online [cit. 2024-04-08]. ISSN 2045-2322. doi:10.1038/s41598-021-96475-5. PMID 34413434.
- ↑ GARNHAM, P. C. THE SUBGENERA OF PLASMODIUM IN MAMMALS. Annales Des Societes Belges De Medecine Tropicale, De Parasitologie, Et De Mycologie. 1964, roč. 44, s. 267–271. Dostupné online [cit. 2024-04-09]. ISSN 0037-9638. PMID 14237568.
- ↑ TEMPLETON, Thomas J.; MARTINSEN, Ellen; KAEWTHAMASORN, Morakot. The rediscovery of malaria parasites of ungulates. Parasitology. 2016-10, roč. 143, čís. 12, s. 1501–1508. Dostupné online [cit. 2024-04-09]. ISSN 1469-8161. doi:10.1017/S0031182016001141. PMID 27444556.
- ↑ SU, Xin-zhuan; WU, Jian. Zoonotic Transmission and Host Switches of Malaria Parasites. Zoonoses. 2021, roč. 1, čís. 1. Dostupné online [cit. 2024-04-08]. ISSN 2737-7466. doi:10.15212/ZOONOSES-2021-0015. PMID 35282332. (anglicky)
- ↑ OUTLAW, Diana C.; RICKLEFS, Robert E. Rerooting the evolutionary tree of malaria parasites. Proceedings of the National Academy of Sciences. 2011-08-09, roč. 108, čís. 32, s. 13183–13187. Dostupné online [cit. 2024-04-09]. ISSN 0027-8424. doi:10.1073/pnas.1109153108. PMID 21730128. (anglicky)
- ↑ POINAR, George. Plasmodium dominicana n. sp. (Plasmodiidae: Haemospororida) from Tertiary Dominican amber. Systematic Parasitology. 2005-05, roč. 61, čís. 1, s. 47–52. Dostupné online [cit. 2024-04-10]. ISSN 0165-5752. doi:10.1007/s11230-004-6354-6. PMID 15928991.
- ↑ a b FLEGR, Jaroslav. Evoluční biologie. 2., opr. a rozš.. vyd. Praha: Academia, 2009. ISBN 978-80-200-1767-3, ISBN 80-200-1767-4. OCLC 505914273 S. 353, 365.
- ↑ ANDREÍNA PACHECO, M.; JUNGE, Randall E.; MENON, Adithyan. The evolution of primate malaria parasites: A study on the origin and diversification of Plasmodium in lemurs. Molecular Phylogenetics and Evolution. 2022-09, roč. 174, s. 107551. Dostupné online [cit. 2024-04-09]. ISSN 1055-7903. doi:10.1016/j.ympev.2022.107551.
- ↑ ATKINSON, C. T.; WOODS, K. L.; DUSEK, R. J. Wildlife disease and conservation in Hawaii: Pathogenicity of avian malaria (Plasmodium relictum) in experimentally infected Iiwi (Vestiaria coccinea). Parasitology. 1995-01, roč. 111, čís. S1, s. S59–S69. Dostupné online [cit. 2024-04-09]. ISSN 1469-8161. doi:10.1017/S003118200007582X. (anglicky)
- ↑ BROOKS, Daniel R.; MCLENNAN, Deborah A. The Evolutionary Origin of Plasmodium falciparum. The Journal of Parasitology. 1992, roč. 78, čís. 3, s. 564–566. Dostupné online [cit. 2024-04-09]. ISSN 0022-3395. doi:10.2307/3283673.
- ↑ VOTÝPKA, J.; KOLÁŘOVÁ, I.; HORÁK, P. & kol. O parazitech a lidech. Praha: Triton, 2018. ISBN 978-80-7553-350-0. S. 30.
- ↑ SIAO, Michelle C.; BORNER, Janus; PERKINS, Susan L. Evolution of Host Specificity by Malaria Parasites through Altered Mechanisms Controlling Genome Maintenance. mBio. 2020-04-28, roč. 11, čís. 2. Dostupné online [cit. 2024-04-10]. ISSN 2161-2129. doi:10.1128/mBio.03272-19. PMID 32184256. (anglicky)
- ↑ MERCEREAU-PUIJALON, O.; MÉNARD, D. Plasmodium vivax and the Duffy antigen: a paradigm revisited. Transfusion Clinique Et Biologique: Journal De La Societe Francaise De Transfusion Sanguine. 2010-09, roč. 17, čís. 3, s. 176–183. Dostupné online [cit. 2024-04-21]. ISSN 1953-8022. doi:10.1016/j.tracli.2010.06.005. PMID 20655790.
- ↑ MOONEY, Jason P; GALLOWAY, Lauren J; RILEY, Eleanor M. Malaria, anemia, and invasive bacterial disease: A neutrophil problem?. Journal of Leukocyte Biology. 2019-03-22, roč. 105, čís. 4, s. 645–655. Dostupné online [cit. 2024-04-10]. ISSN 1938-3673. doi:10.1002/JLB.3RI1018-400R. PMID 30570786. (anglicky)
- ↑ VELAVAN, Thirumalaisamy P. Epstein-Barr virus, malaria and endemic Burkitt lymphoma. EBioMedicine. 2019-01, roč. 39, s. 13–14. Dostupné online [cit. 2024-04-10]. doi:10.1016/j.ebiom.2018.12.041. PMID 30584007. (anglicky)
- ↑ DONG, Yuemei; MANFREDINI, Fabio; DIMOPOULOS, George. Implication of the Mosquito Midgut Microbiota in the Defense against Malaria Parasites. PLoS Pathogens. 2009-05-08, roč. 5, čís. 5, s. e1000423. Dostupné online [cit. 2024-04-11]. ISSN 1553-7374. doi:10.1371/journal.ppat.1000423. (anglicky)
- ↑ EMAMI, S. Noushin; LINDBERG, Bo G.; HUA, Susanna. A key malaria metabolite modulates vector blood seeking, feeding, and susceptibility to infection. Science. 2017-03-10, roč. 355, čís. 6329, s. 1076–1080. Dostupné online [cit. 2024-04-10]. ISSN 0036-8075. doi:10.1126/science.aah4563. (anglicky)
- ↑ a b EMAMI, S. Noushin; HAJKAZEMIAN, Melika; MOZŪRAITIS, Raimondas. Can Plasmodium ’s tricks for enhancing its transmission be turned against the parasite? New hopes for vector control. Pathogens and Global Health. 2019-11-17, roč. 113, čís. 8, s. 325–335. Dostupné online [cit. 2024-04-10]. ISSN 2047-7724. doi:10.1080/20477724.2019.1703398. PMID 31910740. (anglicky)
- ↑ FIALHO, Roberto F.; SCHALL, Jos J. Thermal Ecology of a Malarial Parasite and its Insect Vector: Consequences for the Parasite's Transmission Success. Journal of Animal Ecology. 1995, roč. 64, čís. 5, s. 553–562. Dostupné online [cit. 2024-04-10]. ISSN 0021-8790. doi:10.2307/5799.
- ↑ KWIATKOWSKI, Dominic P. How Malaria Has Affected the Human Genome and What Human Genetics Can Teach Us about Malaria. The American Journal of Human Genetics. 2005-08, roč. 77, čís. 2, s. 171–192. Dostupné online [cit. 2024-04-10]. doi:10.1086/432519. PMID 16001361. (anglicky)
- ↑ SVOBODA, Jiří A.; MACHOLÁN, M. Předkové : evoluce člověka. 2. upravené. vyd. Praha: Academia, 2017. 479 s. ISBN 978-80-200-2750-4, ISBN 80-200-2750-5. OCLC 1011114578 S. 35–37.
- ↑ MAYOR, P.; MAMANI, J.; MONTES, D. Proximate causes of the red face of the bald uakari monkey ( Cacajao calvus ). Royal Society Open Science. 2015-07, roč. 2, čís. 7, s. 150145. Dostupné online [cit. 2024-04-10]. ISSN 2054-5703. doi:10.1098/rsos.150145. PMID 26587272. (anglicky)
- ↑ VITT, L. J.; CALDWELL, J. P. Herpetology – An Introductory Biology of Amphibians and Reptiles. 3. vyd. Burlington; San Diego; London: Academic Press ISBN 978-0-12-374346-6. S. 319. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Plasmodium na Wikimedia Commons
Obrázky, zvuky či videa k tématu Plasmodium na Wikimedia Commons  Taxon Plasmodium ve Wikidruzích
Taxon Plasmodium ve Wikidruzích
Média použitá na této stránce
Autor:
- Information-silk.png: Mark James
- derivative work: KSiOM(Talk)
A tiny blue 'i' information icon converted from the Silk icon set at famfamfam.com
الأنوفيلة الاصْطِفانِيَّة
Вьюрковая цветочница-оу
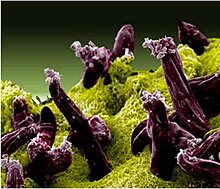
Title: Malaria: Plasmodium gallinaceum
Description: Scanning electron micrograph of Plasmodium gallinaceum invading mosquito midgut. Categories: Research in NIH Labs and Clinics Type: Color, Photo Source: National Institute of Allergy and Infectious Diseases (NIAID) Date Created: October 14, 2007 Date Added: 8/19/2013
Reuse Restrictions: None - This image is in the public domain and can be freely reused. Please credit the source and/or author listed above.Autor: Anthony Allison, Licence: CC0
Comparison of the distribution of malaria (left) and sickle-cell trait (right).
ID#: 1381 Description: Histopathology of malaria exoerythrocytic forms in liver. Histopathology of malaria exoerythrocytic forms in liver. Parasite. Content Providers(s): CDC/Dr. Melvin Creation Date: 1973
Copyright Restrictions: None - This image is in the public domain and thus free of any copyright restrictions. As a matter of courtesy we request that the content provider be credited and notified in any public or private usage of this image.Autor: Image by Ute Frevert; false color by Margaret Shear., Licence: CC BY 2.5
Malaria is caused by a parasite (Plasmodium) transmitted to people and animals by mosquitoes of the genus Anopheles. The sporozoite life-stage of the parasite develops inside oocysts and are released in large numbers into the hemocoel of mosquitoes. This false-colored electron micrograph shows a sporozoite of Plasmodium bergei migrating through the cytoplasm of midgut epithelia of an Anopheles stephensi mosquito.
Autor: NIAID, Licence: CC BY 2.0
Colorized electron micrograph showing malaria parasite (right, blue) attaching to a human red blood cell. The inset shows a detail of the attachment point at higher magnification.
Credit: NIAIDAutor: Oregon State University, Licence: CC BY-SA 2.0
This 15-20 million-year-old mosquito Culex malariager, was discovered in the Dominican Republic preserved in amber, and is infected with the malarial parasite Plasmodium dominicana. It’s the oldest known fossil showing Plasmodium malaria, related to the type that today infects humans. (Photo by George Poinar, Jr., courtesy of Oregon State University)
Autor: OJJ, Licence: CC BY-SA 4.0
Životní cyklus rodu Plasmodium












