Zirkonium
| Zirkonium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Periodická tabulka ↓ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Zirkonium, Zr, 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cizojazyčné názvy | lat. zirconium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, perioda, blok | 4. skupina, 5. perioda, blok d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Přechodné kovy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v zemské kůře | 165 až 220 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v mořské vodě | 0,000022 mg/l | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | Šedý až stříbřitě bílý, kovový prvek | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Registrační číslo CAS | 7440-67-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 91,222(3)[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr | 160 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 175 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iontový poloměr | 79 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronová konfigurace | [Kr] 4d2 5s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační čísla | II, IV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita (Paulingova stupnice) | 1,33 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizační energie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| První | 640,1 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Druhá | 1270 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Třetí | 2218 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Látkové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografická soustava | Šesterečná | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 14,02×10−6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 6,52 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenství | Pevné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tvrdost | 5,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tlak syté páry | 100 Pa při 3197K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 3800 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | 22,6 W⋅m−1⋅K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota tání | 1854,85 °C (2 128 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 4408,85 °C (4 682 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo tání | 14 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo varu | 573 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná tepelná kapacita | 25,36 Jmol−1K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektromagnetické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrická vodivost | 2,36×106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrný elektrický odpor | 421 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní elektrodový potenciál | −1,53 V | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetické chování | Paramagnetický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bezpečnost | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [2] Nebezpečí[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R-věty | R15, R17 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S-věty | S2, S7/8, S43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Zirkonium (chemická značka Zr, latinsky zirconium) je šedý až stříbřitě bílý, kovový prvek, mimořádně odolný proti korozi. Hlavní uplatnění nalézá v jaderné energetice, protože vykazuje velmi nízký účinný průřez pro záchyt neutronů. Dále je složkou různých slitin a protikorozních ochranných vrstev.
Historie
Jako objevitel zirkonia je uváděn Martin Heinrich Klaproth v roce 1789. Nalezl jej rozkladem minerálu jargonu ze Srí Lanky, tehdejšího Cejlonu.
První úspěšný pokus o izolaci elementárního zirkonia provedl roku 1824 chemik Jöns Jacob Berzelius. Jeho produkt nebyl však dokonale čistý a skutečně čisté elementární zirkonium bylo získáno až v roce 1914.
Základní fyzikálně-chemické vlastnosti

Zirkonium je šedý až stříbřitě bílý, středně tvrdý a poměrně lehký kov.
Je supravodičem prvního typu za teplot pod 0,70 K.
Vyznačuje se mimořádnou chemickou stálostí – je zcela netečné k působení vody a odolává působení většiny běžných minerálních kyselin i roztoků alkalických hydroxidů. Pro jeho rozpouštění je nejúčinnější kyselina fluorovodíková (HF) nebo její směsi s jinými minerálními kyselinami.
Zirkonium vykazuje velmi vysokou afinitu ke kyslíku. Jemně rozptýlený kov proto může na vzduchu samovolně vzplanout, zvláště za zvýšené teploty. V kusové podobě (slitky, plechy, dráty) je však na vzduchu naprosto stálé.
Ve sloučeninách se vyskytuje především v mocenství Zr+4, ale jsou známy i sloučeniny Zr+3 a Zr+2.
Výskyt
Zirkonium je v zemské kůře poměrně hojně zastoupeno, jeho obsah se odhaduje na 165–220 mg/kg. V mořské vodě je díky své chemické stálosti přítomno pouze v koncentraci 0,000 022 mg/l. Ve vesmíru připadá jeden atom zirkonia na 1 miliardu atomů vodíku.
Zirkonium se v přírodě vyskytuje pouze ve formě sloučenin. Nalézáme jej v řadě minerálů, které jsou pro své vlastnosti (tvrdost a vzhledová podobnost s diamantem) známy a používány již od dávnověku. Mezi nejvýznamnější patří křemičitan zirkon, ZrSiO4 a oxid zirkonia baddeleyit, ZrO2. Dále jsou známy různé komplexní zirkonáty jako zirkelit, obsahující vápník, železo, titan a thorium nebo uhligit s obsahem vápníku, titanu a hliníku.
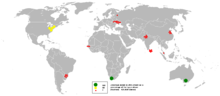
Mezi hlavní oblasti těžby minerálů a hornin s výrazným zastoupením zirkonia patří Austrálie, Brazílie, Indie, Rusko, a USA. Kromě toho jsou k získávání zirkonia často průmyslově využívány i rudy titanu jako ilmenit a rutil.
Výskyt zirkonia byl pomocí spektrální analýzy potvrzen i ve hvězdách podobných našemu Slunci, je složkou řady meteoritů a má významné zastoupení v měsíčních horninách.
Výroba
Průmyslová výroba čistého zirkonia je poměrně nákladná, protože podobně jako v případě titanu nelze použít běžné metalurgické postupy jako redukce uhlím nebo vodíkem. Navíc je většina přírodních surovin zirkonia kontaminována hafniem, které vykazuje velmi podobné chemické vlastnosti a separace těchto příbuzných prvků je značně obtížná.
V současné době se při průmyslové výrobě zirkonia používá především tzv. Krollův proces. Přitom se nejprve pyrolýzou baddeleyitu s uhlíkem a chlorem získává chlorid zirkoničitý ZrCl4.
- ZrO2 + 2 Cl2 + 2 C (900 °C) → ZrCl4 + 2 CO
Frakční destilací se poté oddělí chlorid železitý FeCl3, který vzniká z příměsí železa, vyskytujících se prakticky ve všech přírodních materiálech. Dalším krokem je redukce hořčíkem v inertní argonové atmosféře při teplotě kolem 800 °C.
- ZrCl4 + 2 Mg → Zr + 2 MgCl2
Zirkonium vzniklé touto reakcí obsahuje zbytky chloridu hořečnatého a kovového hořčíku, které se odstraňují působením kyseliny chlorovodíkové HCl. Takto připravené zirkonium obsahuje stále ještě kolem 1% hafnia, které není na překážku běžným aplikacím zirkonia ve slitinách a při povrchové ochraně kovů. Pro využití v jaderné energetice je však třeba toto hafnium oddělit a tento krok zvyšuje přibližně 10x cenu výsledného, hafnia prostého, zirkonia.
Použití
Slitiny zirkonia nacházejí významné uplatnění především v jaderné energetice a povrchové ochraně kovů.
- V současné době je přibližně 90 % světové produkce čistého zirkonia používáno při výrobě elektrické energie v jaderných elektrárnách. Důvodem je skutečnost, že zirkonium velmi málo pohlcuje neutrony a jeho slitiny jsou současně chemicky i mechanicky odolné. Důležitým aspektem pro tento typ použití je důkladné odstranění doprovázejícího hafnia, které vykazuje přibližně 600× větší účinný průřez pro tepelné neutrony.
- Komerčně vyráběné slitiny, z nichž se skládají zařízení v jaderném reaktoru se nazývají Zircaloy. Jde o několik typů slitin, které ve všech případech obsahují přes 97 % Zr, dále jsou do nich legovány kovy jako cín, nikl, chrom a železo. Obsah hafnia by neměl překročit 0,01%. Uvádí se, že v běžném jaderném reaktoru nalezneme kolem 150 000 metrů trubek z těchto slitin.
- Protože zirkonium se v živých organizmech chová zcela inertně, slouží jeho slitiny pro výrobu implantátů, kloubních náhrad a podobných aplikací.
- Významné uplatnění nacházejí slitiny zirkonia v antikorozní ochraně kovů především v chemickém průmyslu, kde navíc slouží i k výrobě vysoce tepelně a korozně namáhaných chemických reaktorů, tepelných výměníků a vakuových aparatur.
- Pyroforických (zápalných) vlastností jemně práškového zirkonia se využívá při výrobě zápalných bomb pro vojenské účely.
- Slitiny s niobem vykazují supravodivé vlastnosti při relativně vysokých teplotách (desítky kelvinů) a slouží pro výrobu supravodivých magnetů.
Sloučeniny

Sloučeninou zirkonia s největším praktickým významem je bezesporu oxid zirkoničitý ZrO2.
- Oxid zirkoničitý, ZrO2, krystalující v krychlové soustavě je velmi významným minerálem zirkonia a v současné době se značné množství vyrábí i synteticky. Důvodem je jeho velmi významná podobnost s diamantem, především vysoký index lomu světla, jen o málo nižší než u skutečného diamantu. Zároveň ZrO2 má tvrdost 8,5. Nejvýznamnější rozdíl je v hustotě těchto dvou materiálů – ZrO2 vykazuje hodnotu 5,6 – 6 g/cm3, zatímco diamant je výrazně nižší hustotu kolem 3,5 g/cm3.
- Kubický oxid zirkoničitý je proto levnější, ale vzhledově velmi podobnou náhradou pravého diamantu. Ve šperkařském průmyslu se každoročně zpracovávají tuny tohoto materiálu při výrobě prstenů, náramků, náhrdelníků a dalších šperků.
- Silná podobnost s diamantem pochopitelně svádí i k jejich úmyslné záměně, protože jen zkušený klenotník dokáže rychle a spolehlivě rozlišit tyto dva materiály. V současné době jsou však již na trhu spolehlivá a cenově dostupná testovací zařízení, kterými je možno spolehlivě odlišit pravý diamant od ZrO2.
- Technologicky velmi významná je keramika na bázi ZrO2. Ve slévárenství a sklářském průmyslu patří tavicí nádoby a vystýlky tavicích pecí vyrobené ze zirkonoxidové keramiky k nejkvalitnějším a jejich skutečně masovému nasazení brání pouze jejich výrazně vyšší cena oproti materiálům na bázi grafitu nebo Al2O3.
Biologický význam
Díky nízké rozpustnosti zirkonia ve vodě je jeho obsah v živých organizmech nízký a zirkonium rozhodně nepatří mezi biogenní prvky, jejichž nedostatek ve stravě výrazněji ovlivňuje fyziologický stav organizmu.
Slitiny zirkonia jsou však ve zdravotnictví využívány jako materiály k výrobě různých tělních implantátů, kloubních náhrad a podobných aplikací.
Odkazy
Reference
- ↑ International Union of Pure and Applied Chemistry. Standard atomic weights of three technology critical elements revised. IUPAC News [online]. 2024-10-23 [cit. 2024-10-30]. Dostupné online. (anglicky)
- ↑ a b Zirconium. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood – A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
(c) Anwar saadat na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
This bubble map shows the global distribution of zirconium output in 2005 as a percentage of the top producer (Australia - 426,000 tonnes).
This map is consistent with incomplete set of data too as long as the top producer is known. It resolves the accessibility issues faced by colour-coded maps that may not be properly rendered in old computer screens.
Data was extracted on 16th June 2007. Source - http://www.bgs.ac.uk/mineralsuk/commodity/world/home.html (Archived at https://web.archive.org/web/20070809194502/http://www.mineralsuk.com/britmin/wmp_2001_2005.pdf 18:24, 25 January 2016 (UTC))
Based on :Image:BlankMap-World.pngAutor: Alchemist-hp (pse-mendelejew.de)., Licence: FAL
Kovové zirkonium o čistotě 99,97 %.
Autor: Dschwen, Licence: CC BY 2.5
Zirconium rod. Image taken by User:Dschwen on January 12th 2006.
Autor: Gregory Phillips, Licence: CC BY-SA 3.0
Photo of a round brilliant-cut cubic zirconia. Due to its low cost and close visual likeness to diamond, cubic zirconia has remained the most gemologically and economically important diamond simulant elma since 1976.
Autor: McZusatz (talk), Licence: CC0
Zirconium spectrum; 400 nm - 700 nm